NHRI Communications

會議報導
疫苗臨床試驗案之要求與審查重點(一)
Conference report – Quality Concern in a Vaccine Clinical Trial (Part I)
 本院於2008年10月23日在竹南院區與財團法人醫藥品查驗中心及奇異亞洲醫療設備股份有限公司共同舉辦為期1天的「2008疫苗臨床試驗研討會」,針對疫苗臨床試驗之相關議題,邀請國內外專家學者前來進行經驗分享與意見交流,並紀念甫過世的抗癌鬥士朱夢麟醫師。會議中有關「疫苗臨床試驗案要求與審查重點」的議題,邀請查驗中心審查員李元鳳博士及詹明曉醫師分別就申請臨床試驗時,疫苗類藥品的品質、臨床要求、與審查重點進行說明。
本院於2008年10月23日在竹南院區與財團法人醫藥品查驗中心及奇異亞洲醫療設備股份有限公司共同舉辦為期1天的「2008疫苗臨床試驗研討會」,針對疫苗臨床試驗之相關議題,邀請國內外專家學者前來進行經驗分享與意見交流,並紀念甫過世的抗癌鬥士朱夢麟醫師。會議中有關「疫苗臨床試驗案要求與審查重點」的議題,邀請查驗中心審查員李元鳳博士及詹明曉醫師分別就申請臨床試驗時,疫苗類藥品的品質、臨床要求、與審查重點進行說明。
疫苗類藥品的品質與審查重點
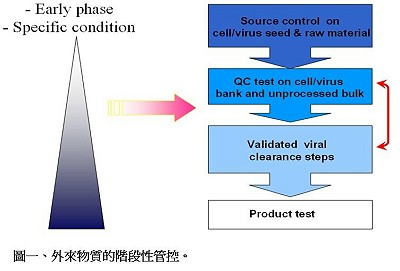
此場次中,李元鳳博士說明臨床試驗階段疫苗類藥品的化學、製造與管制 (Chemistry, Manufacturing and Controls, 以下簡稱 CMC)文件之重要項目及病毒安全控制注意事項。在第一期臨床試驗階段,優先考量的是疫苗的安全性相關品質管制,例如:不純物、無菌、熱原(pyrogen)、病毒安全性等。〈更多內容〉
《文/圖:醫藥品查驗中心審查員李元鳳博士演講;編輯中心吳萃慧整理》