第 660 期 2016-07-29
知識產權 新藥再創新猷—漫談2015年美國FDA核准小分子新藥(中 )
Introduction to FDA approved novel small molecular drugs in 2015 (part 2) 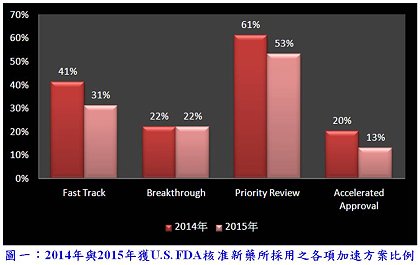 2014年與2015年堪稱是新藥研發的豐收年,除了U.S. FDA於審查效能的提升外,加速方案縮短新藥審查的時間亦扮演了相當重要的角色,這兩年分別有66%(27/41)與60%(27/45)的新藥獲得一種或一種以上加速方案,以罕見疾病用藥與醫療需求用藥為主要,各種方案採用之比例如圖一所示「註1」。上期「註2」 介紹的抗癌藥物具一種或一種以上加速方案資格的比例甚高(9/11),本期接續介紹的4個感染性疾病藥物皆具有這類資格,而Avycaz® 和Cresemba® 又是被授予合格感染性疾病產品資格(Qualified Infectious Disease Product, QIDP)而獲得核准的抗生素。心臟疾病與精神分裂症小分子藥物亦於本期呈現,其中Corlanor® 與Entresto® 具快速審查與優先審查兩項資格,另外6個藥物則未獲任一加速方案資格,相較之下,所需平均審查時間確實略長。〈更多內容〉
2014年與2015年堪稱是新藥研發的豐收年,除了U.S. FDA於審查效能的提升外,加速方案縮短新藥審查的時間亦扮演了相當重要的角色,這兩年分別有66%(27/41)與60%(27/45)的新藥獲得一種或一種以上加速方案,以罕見疾病用藥與醫療需求用藥為主要,各種方案採用之比例如圖一所示「註1」。上期「註2」 介紹的抗癌藥物具一種或一種以上加速方案資格的比例甚高(9/11),本期接續介紹的4個感染性疾病藥物皆具有這類資格,而Avycaz® 和Cresemba® 又是被授予合格感染性疾病產品資格(Qualified Infectious Disease Product, QIDP)而獲得核准的抗生素。心臟疾病與精神分裂症小分子藥物亦於本期呈現,其中Corlanor® 與Entresto® 具快速審查與優先審查兩項資格,另外6個藥物則未獲任一加速方案資格,相較之下,所需平均審查時間確實略長。〈更多內容〉
《文/圖:生技與藥物研究所謝興邦研究員、李靜琪副研究員;審校:生技與藥物研究所陳炯東研究員》



