NHRI Communications

知識產權
新藥再創新猷—漫談2015年美國FDA核准小分子新藥(中)
Introduction to FDA approved novel small molecular drugs in 2015 (part 2)
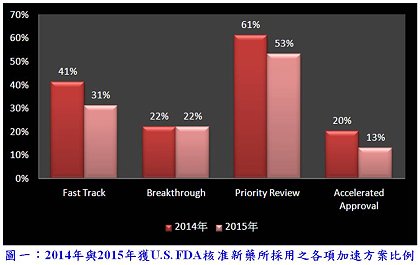 2014年與2015年堪稱是新藥研發的豐收年,除了U.S. FDA於審查效能的提升外,加速方案縮短新藥審查的時間亦扮演了相當重要的角色,這兩年分別有66%(27/41)與60%(27/45)的新藥獲得一種或一種以上加速方案,以罕見疾病用藥與醫療需求用藥為主要,各種方案採用之比例如圖一所示「註1」。上期「註2」 介紹的抗癌藥物具一種或一種以上加速方案資格的比例甚高(9/11),本期接續介紹的4個感染性疾病藥物皆具有這類資格,而Avycaz® 和Cresemba® 又是被授予合格感染性疾病產品資格(Qualified Infectious Disease Product, QIDP)而獲得核准的抗生素。心臟疾病與精神分裂症小分子藥物亦於本期呈現,其中Corlanor® 與Entresto® 具快速審查與優先審查兩項資格,另外6個藥物則未獲任一加速方案資格,相較之下,所需平均審查時間確實略長。
2014年與2015年堪稱是新藥研發的豐收年,除了U.S. FDA於審查效能的提升外,加速方案縮短新藥審查的時間亦扮演了相當重要的角色,這兩年分別有66%(27/41)與60%(27/45)的新藥獲得一種或一種以上加速方案,以罕見疾病用藥與醫療需求用藥為主要,各種方案採用之比例如圖一所示「註1」。上期「註2」 介紹的抗癌藥物具一種或一種以上加速方案資格的比例甚高(9/11),本期接續介紹的4個感染性疾病藥物皆具有這類資格,而Avycaz® 和Cresemba® 又是被授予合格感染性疾病產品資格(Qualified Infectious Disease Product, QIDP)而獲得核准的抗生素。心臟疾病與精神分裂症小分子藥物亦於本期呈現,其中Corlanor® 與Entresto® 具快速審查與優先審查兩項資格,另外6個藥物則未獲任一加速方案資格,相較之下,所需平均審查時間確實略長。感染性疾病藥物
相較於2014年的11個藥物獲准上市,抗感染性疾病藥物在2015年僅有4個:DaklinzaTM為抗C型肝炎藥物,Genvoya® 為抗HIV藥物,Avycaz® 和Cresemba®分別用於治療細菌與真菌所引起的感染疾病之抗生素。
(1) DaklinzaTM (daclatasvir)
 繼2013與2014年Gilead Sciences(GS)公司分別推出治療C型肝炎藥物Sovaldi®(sofosbuvir)與Harvoni®(ledipasvir/sofosbuvir),2014年AbbVie公司也推出Viekira PakTM (ombitasvir/ paritaprevir/ ritonavir with dasabuvir)複方藥物,Bristol-Myers Squibb(BMS)公司的DaklinzaTM(daclatasvir, BMS-790052 )在經歷了一些波折之後,終於在2015年7月24日獲得U.S. FDA核准合併GS公司的Sovaldi® 使用,是首款在不需要與干擾素或ribavirin共同使用的情況下,對抗第3型C型肝炎(GT-3HCV)感染的治療藥物。DaklinzaTM的核准是基於臨床III期(ALLY–3)的結果,152位基因型第3型的C型肝炎患者(101例初次治療,51例有治療史)接受為期12週的DaklinzaTM (60毫克)加Sovaldi®(400毫克)方案治療,最終以各治療組完成治療後24週時的病毒持續性反應(sustained virologic response, SVR)作為治療成功率之判斷,此時血清中HCV RNA應低於檢測極限(<50 IU/mL)。數據顯示:沒有肝硬化的患者,98%的新患者或92%有治療史的患者,在用藥半年後血液中就檢測不到殘留的病毒;而曾有肝硬化的患者,58%的新患者或69%有治療的患者,用藥半年後血液中即檢測不到殘留的病毒。
繼2013與2014年Gilead Sciences(GS)公司分別推出治療C型肝炎藥物Sovaldi®(sofosbuvir)與Harvoni®(ledipasvir/sofosbuvir),2014年AbbVie公司也推出Viekira PakTM (ombitasvir/ paritaprevir/ ritonavir with dasabuvir)複方藥物,Bristol-Myers Squibb(BMS)公司的DaklinzaTM(daclatasvir, BMS-790052 )在經歷了一些波折之後,終於在2015年7月24日獲得U.S. FDA核准合併GS公司的Sovaldi® 使用,是首款在不需要與干擾素或ribavirin共同使用的情況下,對抗第3型C型肝炎(GT-3HCV)感染的治療藥物。DaklinzaTM的核准是基於臨床III期(ALLY–3)的結果,152位基因型第3型的C型肝炎患者(101例初次治療,51例有治療史)接受為期12週的DaklinzaTM (60毫克)加Sovaldi®(400毫克)方案治療,最終以各治療組完成治療後24週時的病毒持續性反應(sustained virologic response, SVR)作為治療成功率之判斷,此時血清中HCV RNA應低於檢測極限(<50 IU/mL)。數據顯示:沒有肝硬化的患者,98%的新患者或92%有治療史的患者,在用藥半年後血液中就檢測不到殘留的病毒;而曾有肝硬化的患者,58%的新患者或69%有治療的患者,用藥半年後血液中即檢測不到殘留的病毒。全世界預估有1,700萬人受到C型肝炎感染,而在美國境內約有270萬的感染人口,近75%為基因型第1型,其中2/3為基因型1a、1/3為基因型1b,基因型第2型有16%,基因型第3型有12%。台灣C肝患者約有50至60萬人,以基因型1b(66-71%)、2a(20%)和2b(10%)為主。DaklinzaTM是一種強效NS5A複製複合體(replication complex)抑制劑,於2014年8月已獲歐盟核准,合併NS5B(RNA 聚合酶(polymerase))抑制劑 Sovaldi® 使用,可用於基因型第1、2、3和4型C型肝炎成人患者的治療。以12週療程為例,DaklinzaTM 價格為63,000美元,Sovaldi® 為84,000美元,Harvoni® 為95,000美元,Viekira PakTM 為83,300美元;保險公司估計可從藥廠獲得40%的折扣。DaklinzaTM/Sovaldi® 是一種每日1次、口服、治癒率達100%的C型肝炎雞尾酒療法,為廣泛基因型C型肝炎患者提供了一種潛在治癒的治療選擇,包括一些難治性群體,如既往治療失敗的群體,這對GS公司開發的Harvoni® 雞尾酒療法將形成直接威脅。
(2) Genvoya® (elvitegravir/cobicistat/emtricitabine/tenofovir alafenamide)
GS公司近三年每一年都有新藥獲U.S. FDA核准上市,2013年抗C型肝炎藥物Sovaldi® 、2014年抗C型肝炎複方藥物Harvoni® 與2015年11月05日的抗HIV藥物Genvoya® (elvitegravir/cobicistat/emtricitabine/ tenofovir alafenamide)。Genvoya® 為複方片劑,每片含150毫克的elvitegravir(EVG, GS-9137;嵌合酶(integrase)抑制劑)、150毫克的cobicistat (Tybost, GS-9350;CYP3A4抑制劑,為藥物增效劑)、200毫克的emtricitabine (FTC, Emtriva, Coviracil;cytidine類似物核苷酸反轉錄酶抑制劑(nucleoside reverse transcriptase inhibitor, NRTI),以及10毫克的tenofovir alafenamide(TAF, GS-7340, Tenofovir前驅物;adenosine 類似物NRTI)。其實GS公司在2012年就推出Stribild® 雞尾酒療法(elvitegravir/cobicistat/emtricitabine/tenofovir disoproxil, Quad pill),兩者最大的差別只在於以TAF取代tenofovir disoproxil(TDF)。相對於TDF(Viread® ),TAF臨床給藥劑量更小,更容易進入細胞發揮藥效,尤其是HIV感染細胞,能發揮更強的抗病毒療效。就安全性而言,Genvoya® 較Stribild®更能維持腎功能,減少患者骨折風險。
此次GS公司為了要比其他競爭者早一點達陣,故使用他們在2014年11月19 日以1.25億美元自加拿大魁北克蒙特婁的Knight Therapeutics公司所買下的一張藥品優先審查券(Tropical Disease Priority Review Voucher, PRV),可使U.S. FDA審查藥物時間從10個月縮短至6個月(Knight Therapeutics公司是因為2014年成功開發治療什曼原蟲症的Impavido® 藥物而獲得此PRV);GS宣布Genvoya® 1年藥價為31,362美元。
(3) Avycaz® (ceftazidime/avibactam)
 抗菌藥物的研發具重要性與緊迫性,在美國政府利用《GAIN法案》與QIDP認證雙重加持下,2014年共有9個感染症藥物上市,而2015年則有2個抗感染藥物上市。在2015年2月25日,U.S. FDA核准Avycaz®(ceftazidime/avibactam, CAZ-AVI)用於複雜性腹腔內感染(complicated intra-abdominal infections, cIAI)(與metronidazole合併使用)和複雜性尿路感染(complicated urinary tract infections, cUTI)成人患者的治療。Avycaz®為複方靜脈藥物,其中ceftazidime(2,000毫克)是第三代廣效型頭孢菌素(cephalosporin),常用於治療嚴重革蘭氏陰性菌感染,其抗菌機轉與青黴素類藥物相同,能與細菌細胞膜上的盤尼西林結合蛋白(penicillin-binding proteins, PBPs)結合,阻止細菌細胞壁黏肽(mucopeptide)的合成;avibactam(500毫克)則是一種新型乙內醯胺酸酶(β-lactamase)抑制劑,可保護ceftazidime免於被耐藥陰性菌所產生的β-lactamase分解。Avycaz® 獲核准是基於2個臨床II期試驗結果,顯示Avycaz® 靜脈注射2小時組(每8小時1次)相對於doripenem靜脈30分鐘控制組的療效和安全性,於統計上均不輸於傳統治療。
抗菌藥物的研發具重要性與緊迫性,在美國政府利用《GAIN法案》與QIDP認證雙重加持下,2014年共有9個感染症藥物上市,而2015年則有2個抗感染藥物上市。在2015年2月25日,U.S. FDA核准Avycaz®(ceftazidime/avibactam, CAZ-AVI)用於複雜性腹腔內感染(complicated intra-abdominal infections, cIAI)(與metronidazole合併使用)和複雜性尿路感染(complicated urinary tract infections, cUTI)成人患者的治療。Avycaz®為複方靜脈藥物,其中ceftazidime(2,000毫克)是第三代廣效型頭孢菌素(cephalosporin),常用於治療嚴重革蘭氏陰性菌感染,其抗菌機轉與青黴素類藥物相同,能與細菌細胞膜上的盤尼西林結合蛋白(penicillin-binding proteins, PBPs)結合,阻止細菌細胞壁黏肽(mucopeptide)的合成;avibactam(500毫克)則是一種新型乙內醯胺酸酶(β-lactamase)抑制劑,可保護ceftazidime免於被耐藥陰性菌所產生的β-lactamase分解。Avycaz® 獲核准是基於2個臨床II期試驗結果,顯示Avycaz® 靜脈注射2小時組(每8小時1次)相對於doripenem靜脈30分鐘控制組的療效和安全性,於統計上均不輸於傳統治療。Avycaz® 原本由美國製藥公司Forest Laboratories和法國藥廠AstraZeneca聯合開發,但2014年2月,愛爾蘭Actavis公司耗資250億美元收購Forest Laboratories公司後,又於2015年3月17日以705億美元收購了Allergan公司,並將新公司命名為Allergan。根據協議,Allergan公司擁有Avycaz® 在北美市場的權利,而全球其他區域權利則由AstraZeneca藥廠擁有。值得一提的是,Avycaz® 將成為Allergan公司對抗Merck藥廠的ZerbaxaTM(2014年上市)的有力武器,ZerbaxaTM當年是由抗生素巨頭Cubist公司開發,Merck藥廠於2014年底耗資95億美元收購了Cubist公司,而ZerbaxaTM 便是該筆收購的關鍵因素。ZerbaxaTM 的藥物組成與Avycaz® 相似,也是由一種新型頭孢菌素(ceftolozane)配上一種β-lactamase抑制劑(tazobactam)組成的複方藥品,兩者的治療領域亦相同(治療cUTI和cIAI)。Avycaz® 的銷售峰值預計為10億美元。
(4) Cresemba® (isavuconazonium sulfate)
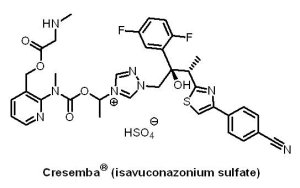 2015 年3 月6 日,U.S. FDA以優先審查和QICP資格核准日本 Astellas Pharma 公司研發的抗真菌藥物Cresemba® (isavuconazonium sulfate, BAL4815)上市,用於治療侵入性麴菌症(invasive aspergillosis)和侵入性白黴菌病(invasive mucormycosis),這兩種真菌感染屬於罕見疾病,主要發生於免疫系統紊亂或受到抑制的患者,如白血病患者。Isavuconazonium sulfate是Isavuconazole(BAL4815)前驅物,進入體內後代謝為Isavuconazole進而發揮抗真菌的作用。Cresemba® 屬於第二代三唑類廣效抗真菌藥物,這類藥物以真菌細胞壁為靶點,有口服與注射兩種劑型。U.S. FDA的核准是基於一項收錄516名受試者之臨床III期試驗結果,試驗組給予Cresemba® ,對照組給予voriconazole(Pfizer藥廠旗下抗真菌藥,商品名Vfend® ),結果顯示Cresemba® 在治療這些嚴重真菌感染時,較voriconazole有較低的死亡率。Cresemba® 具有高口服吸收、不受食物影響以及不良反應較小的優點。
2015 年3 月6 日,U.S. FDA以優先審查和QICP資格核准日本 Astellas Pharma 公司研發的抗真菌藥物Cresemba® (isavuconazonium sulfate, BAL4815)上市,用於治療侵入性麴菌症(invasive aspergillosis)和侵入性白黴菌病(invasive mucormycosis),這兩種真菌感染屬於罕見疾病,主要發生於免疫系統紊亂或受到抑制的患者,如白血病患者。Isavuconazonium sulfate是Isavuconazole(BAL4815)前驅物,進入體內後代謝為Isavuconazole進而發揮抗真菌的作用。Cresemba® 屬於第二代三唑類廣效抗真菌藥物,這類藥物以真菌細胞壁為靶點,有口服與注射兩種劑型。U.S. FDA的核准是基於一項收錄516名受試者之臨床III期試驗結果,試驗組給予Cresemba® ,對照組給予voriconazole(Pfizer藥廠旗下抗真菌藥,商品名Vfend® ),結果顯示Cresemba® 在治療這些嚴重真菌感染時,較voriconazole有較低的死亡率。Cresemba® 具有高口服吸收、不受食物影響以及不良反應較小的優點。Cresemba® 由原開發廠商瑞士Basilea Pharmaceuticals公司進行到臨床III期時,於2010年2月24日技轉予日本Astellas藥廠並共同開發。Astellas藥廠支付Basilea Pharmaceuticals公司0.86億美元先期技轉金、5.5億美元開發與銷售里程碑金,以及15% ~ 25%銷售權利金。Cresemba® 藥物的預期銷售達5億美元。
心血管疾病藥物
心血管疾病方面於2015年有5個小分子新藥獲准上市,分別是用於治療心臟衰竭的Corlanor® 與Entresto® 、抗凝血藥物Savaysa® 與Kengreal® ,以及肺動脈高壓治療藥物Uptravi® 。
(1) Corlanor® (ivabradine)
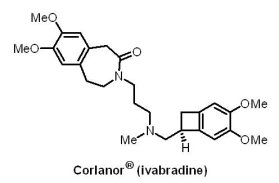 Amgen公司自法國Servier藥廠手中購得Corlanor®(ivabradine)的美國商業化權利,此藥物獲U.S. FDA優先審查(priority review program)與快速審查(fast track designation),於2015年4月15日獲准上市,是Amgen公司首個心血管藥品,也是世界上首個降低心臟病患者心跳速率和住院率的藥物。Corlanor® 是一種口服的超極化活化環核苷酸閘控通道阻斷劑(hyperpolarization-activated cyclic nucleotide-gated channel blocker),藉由選擇性且專一性地抑制心臟的節律If電流,達到降低心跳速率的作用,其適用患者為左心室射出分率(left ventricular ejection fraction;LVEF)<35%、竇性節律(sinus rhythm)>70次/分,且已服用最大劑量或不適合服用β-阻斷劑(β-blocker)之穩定性慢性心臟衰竭患者,可以成功降低這類患者因心臟衰竭所導致的住院風險。然而,儘管此藥物成功降低患者每分鐘心跳次數10次,Corlanor® 在歐洲卻因一項冠狀動脈疾病的臨床試驗結果顯示心臟病死亡率與對照組未產生明顯區別而引起爭議。
Amgen公司自法國Servier藥廠手中購得Corlanor®(ivabradine)的美國商業化權利,此藥物獲U.S. FDA優先審查(priority review program)與快速審查(fast track designation),於2015年4月15日獲准上市,是Amgen公司首個心血管藥品,也是世界上首個降低心臟病患者心跳速率和住院率的藥物。Corlanor® 是一種口服的超極化活化環核苷酸閘控通道阻斷劑(hyperpolarization-activated cyclic nucleotide-gated channel blocker),藉由選擇性且專一性地抑制心臟的節律If電流,達到降低心跳速率的作用,其適用患者為左心室射出分率(left ventricular ejection fraction;LVEF)<35%、竇性節律(sinus rhythm)>70次/分,且已服用最大劑量或不適合服用β-阻斷劑(β-blocker)之穩定性慢性心臟衰竭患者,可以成功降低這類患者因心臟衰竭所導致的住院風險。然而,儘管此藥物成功降低患者每分鐘心跳次數10次,Corlanor® 在歐洲卻因一項冠狀動脈疾病的臨床試驗結果顯示心臟病死亡率與對照組未產生明顯區別而引起爭議。(2) Entresto® (valsartan/sacubitril)
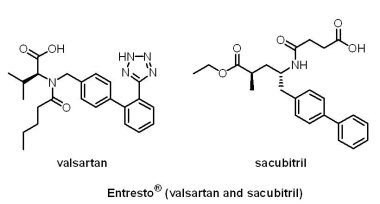 Novartis藥廠的Entresto® (valsartan/sacubitril)亦獲優先審查與快速審查,於2015年7月7日獲准上市,較預定的優先審查執行日期提前6週。Entresto® 是一種血管收縮素受體-腦啡肽酶抑制劑(angiotensin-receptor neprilysin inhibitor, ARNI),是由既有藥物血管收縮素II受體拮抗劑(Angiotensin II receptor antagonist)valsartan與新開發的腦啡肽酶抑制劑(neprilysin inhibitor)sacubitril 所組成的複方藥物,在超過8,000位成人受試者的臨床試驗結果顯示,相較於血管收縮素轉化酶(angiotensin converting enzyme,ACE)抑制劑Enalapril® ,Entresto® 可明顯降低心臟衰竭患者的死亡率與因心衰惡化所導致的住院風險,常見的副作用為低血壓、高血鉀與腎功能不全。黑人或有病史的患者具有較高的血管性水腫(angioedema)發生風險。醫護人員須提醒患者不要同時服用Entresto® 與血管收縮素轉化酶抑制劑,兩者至少須間隔36小時,以避免血管性水腫的發生風險;此外,為避免危害胎兒,孕婦須停用Entresto®。
Novartis藥廠的Entresto® (valsartan/sacubitril)亦獲優先審查與快速審查,於2015年7月7日獲准上市,較預定的優先審查執行日期提前6週。Entresto® 是一種血管收縮素受體-腦啡肽酶抑制劑(angiotensin-receptor neprilysin inhibitor, ARNI),是由既有藥物血管收縮素II受體拮抗劑(Angiotensin II receptor antagonist)valsartan與新開發的腦啡肽酶抑制劑(neprilysin inhibitor)sacubitril 所組成的複方藥物,在超過8,000位成人受試者的臨床試驗結果顯示,相較於血管收縮素轉化酶(angiotensin converting enzyme,ACE)抑制劑Enalapril® ,Entresto® 可明顯降低心臟衰竭患者的死亡率與因心衰惡化所導致的住院風險,常見的副作用為低血壓、高血鉀與腎功能不全。黑人或有病史的患者具有較高的血管性水腫(angioedema)發生風險。醫護人員須提醒患者不要同時服用Entresto® 與血管收縮素轉化酶抑制劑,兩者至少須間隔36小時,以避免血管性水腫的發生風險;此外,為避免危害胎兒,孕婦須停用Entresto®。(3) Savaysa® (edoxaban)
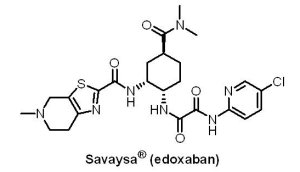 Daiichi Sankyo公司的抗凝血劑Savaysa®(edoxaban, DU-176b)於2015年1月8日獲准用於治療深層靜脈栓塞(deep vein thrombosis)、肺栓塞(pulmonary embolism)及降低非瓣膜性心房纖維性顫動(non-valvular atrial fibrillation)患者發生中風和全身性栓塞的機率。Savaysa® 為Factor Xa抑制劑,於2011年即先以另一商品名Lixiana® 獲日本厚生省核准,用於預防接受膝關節或髖關節置換手術的患者發生靜脈血栓栓塞的風險,更於2014年9月獲准擴大適應症,用於非瓣膜性心房纖維性顫動患者。Savaysa® 是第4個上市的口服抗凝血劑,除了面臨市場競爭的問題外,亦因肌酸酐清除率(creatinine clearance rate, CrCl)>95 mL/min,心房顫動患者使用Savaysa® 時發生缺血性中風的機率高於Warfarin,使得U.S. FDA決定「黑框警告(black-box warning)」限制該藥物的適用範圍。
Daiichi Sankyo公司的抗凝血劑Savaysa®(edoxaban, DU-176b)於2015年1月8日獲准用於治療深層靜脈栓塞(deep vein thrombosis)、肺栓塞(pulmonary embolism)及降低非瓣膜性心房纖維性顫動(non-valvular atrial fibrillation)患者發生中風和全身性栓塞的機率。Savaysa® 為Factor Xa抑制劑,於2011年即先以另一商品名Lixiana® 獲日本厚生省核准,用於預防接受膝關節或髖關節置換手術的患者發生靜脈血栓栓塞的風險,更於2014年9月獲准擴大適應症,用於非瓣膜性心房纖維性顫動患者。Savaysa® 是第4個上市的口服抗凝血劑,除了面臨市場競爭的問題外,亦因肌酸酐清除率(creatinine clearance rate, CrCl)>95 mL/min,心房顫動患者使用Savaysa® 時發生缺血性中風的機率高於Warfarin,使得U.S. FDA決定「黑框警告(black-box warning)」限制該藥物的適用範圍。(4) Kengreal® (cangrelor)
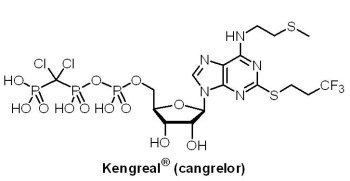 Medicines公司的Kengreal® (cangrelor, AR-C69931MX)是一個P2Y12(purinergic receptor P2Y, G-protein coupled,12)血小板受體抑制劑,藉由阻斷二磷酸腺苷(adenosine diphosphate, ADP)誘發的血小板凝集,可以避免成人患者在經皮冠狀動脈介入治療(percutaneous coronary intervention, PCI)過程中,因凝血而引起的冠狀動脈堵塞。於2015年6月22日獲核准上市;更早之前(2015年3月),Kengreal® 就已獲歐盟核准,是歐盟首個静脈抗血小板藥物。Kengreal® 是AstraZeneca藥廠自英國一家公司所收購得到的產品,Medicines公司隨後於2003年自AstraZeneca藥廠手中取得Kengreal® 的開發權,並且針對其僅3至5分鐘的半衰期特點,調整了研發方向,作為短效靜脈注射手術用藥,患者於停止注射Kengreal® 後1小時內血小板功能即可恢復正常。Kengreal® 曾於2014年以急性心臟病患者術前抗凝藥申請上市,但未獲U.S. FDA核准,在縮小了適用範圍為未曾用過P2Y12血小板抑制劑與沒有正在使用糖蛋白 IIb/IIIa 抑制劑的患者後,終於獲得核准為二線藥物上市。
Medicines公司的Kengreal® (cangrelor, AR-C69931MX)是一個P2Y12(purinergic receptor P2Y, G-protein coupled,12)血小板受體抑制劑,藉由阻斷二磷酸腺苷(adenosine diphosphate, ADP)誘發的血小板凝集,可以避免成人患者在經皮冠狀動脈介入治療(percutaneous coronary intervention, PCI)過程中,因凝血而引起的冠狀動脈堵塞。於2015年6月22日獲核准上市;更早之前(2015年3月),Kengreal® 就已獲歐盟核准,是歐盟首個静脈抗血小板藥物。Kengreal® 是AstraZeneca藥廠自英國一家公司所收購得到的產品,Medicines公司隨後於2003年自AstraZeneca藥廠手中取得Kengreal® 的開發權,並且針對其僅3至5分鐘的半衰期特點,調整了研發方向,作為短效靜脈注射手術用藥,患者於停止注射Kengreal® 後1小時內血小板功能即可恢復正常。Kengreal® 曾於2014年以急性心臟病患者術前抗凝藥申請上市,但未獲U.S. FDA核准,在縮小了適用範圍為未曾用過P2Y12血小板抑制劑與沒有正在使用糖蛋白 IIb/IIIa 抑制劑的患者後,終於獲得核准為二線藥物上市。(5) Uptravi® (selexipag)
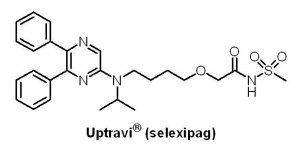 2015年12月22日Actelion公司的Uptravi®(selexipag)獲准用於治療肺動脈高壓(pulmonary arterial hypertension, PAH)。肺動脈高壓是一種肺循環的罕見疾病,發生率約每百萬人中有15至50人,好發於36至50歲女性,在臨床症狀上,通常出現呼吸急促、肺功能容量降低,最終造成右心室衰竭及死亡。患者在疾病確診後,若未施予針對此病的藥物,其平均壽命約2.8年。Uptravi® 為一口服前列腺素IP受體活化劑(IP prostacyclin receptor agonist),藉由鬆弛血管平滑肌以擴張血管並降低肺動脈壓力。Uptravi® 於1,156位肺動脈高壓患者的臨床III期試驗中被證實可顯著減少患者的住院率與病程惡化的風險。Uptravi® 於美國的價格定於每位患者每年約16至17萬美元,其2016年的湯森路透預估銷售額為12.68億美元。
2015年12月22日Actelion公司的Uptravi®(selexipag)獲准用於治療肺動脈高壓(pulmonary arterial hypertension, PAH)。肺動脈高壓是一種肺循環的罕見疾病,發生率約每百萬人中有15至50人,好發於36至50歲女性,在臨床症狀上,通常出現呼吸急促、肺功能容量降低,最終造成右心室衰竭及死亡。患者在疾病確診後,若未施予針對此病的藥物,其平均壽命約2.8年。Uptravi® 為一口服前列腺素IP受體活化劑(IP prostacyclin receptor agonist),藉由鬆弛血管平滑肌以擴張血管並降低肺動脈壓力。Uptravi® 於1,156位肺動脈高壓患者的臨床III期試驗中被證實可顯著減少患者的住院率與病程惡化的風險。Uptravi® 於美國的價格定於每位患者每年約16至17萬美元,其2016年的湯森路透預估銷售額為12.68億美元。精神分裂症藥物
2015年有3個用於精神分裂症治療的小分子新藥獲准上市,這3個藥物均帶有黑框警告,提醒該藥未被核准用於老年失智症患者(dementia-related psychosis)的治療,且會增加此類患者的死亡風險。
(1) Rexulti® (brexpiprazole)
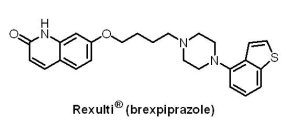 2015年7月10日Otsuka公司的口服藥物Rexulti®(brexpiprazole)獲准用於成人的精神分裂症(schizophrenia)的治療與作為成人重度憂鬱症(major depressive disorder, MDD)的輔助藥物。Rexulti® 是5-HT1A受體與多巴胺D2/3受體局部活化劑(partial agonist),對5-HT2A受體、α1B-受體及正腎上腺素受體(α2C-adrenergic receptor)則具有拮抗效果,其減輕精神分裂症患者精神症狀的效果已在1,310位受試者、為期6週的臨床試驗被證實;而在為期6週共1,046位受試者的兩個臨床試驗中,同時服用Rexulti® 與抗憂鬱藥的重度憂鬱症患者具有較少的憂鬱症狀;常見的副作用為體重增加和內心感覺不安。Rexulti® 帶有黑框警告,提醒該藥會增加老年失智症患者的死亡風險,此藥物未被核准用於此類患者的治療;此外,亦提醒抗憂鬱藥的使用會增加兒童、青少年和青壯年自殺的想法或行為風險,應對此進行監控。
2015年7月10日Otsuka公司的口服藥物Rexulti®(brexpiprazole)獲准用於成人的精神分裂症(schizophrenia)的治療與作為成人重度憂鬱症(major depressive disorder, MDD)的輔助藥物。Rexulti® 是5-HT1A受體與多巴胺D2/3受體局部活化劑(partial agonist),對5-HT2A受體、α1B-受體及正腎上腺素受體(α2C-adrenergic receptor)則具有拮抗效果,其減輕精神分裂症患者精神症狀的效果已在1,310位受試者、為期6週的臨床試驗被證實;而在為期6週共1,046位受試者的兩個臨床試驗中,同時服用Rexulti® 與抗憂鬱藥的重度憂鬱症患者具有較少的憂鬱症狀;常見的副作用為體重增加和內心感覺不安。Rexulti® 帶有黑框警告,提醒該藥會增加老年失智症患者的死亡風險,此藥物未被核准用於此類患者的治療;此外,亦提醒抗憂鬱藥的使用會增加兒童、青少年和青壯年自殺的想法或行為風險,應對此進行監控。(2) VraylarTM (cariprazine)
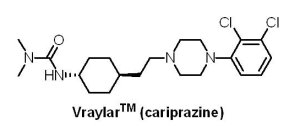 2015年9月17日U.S. FDA 核准Allergan公司的VraylarTM(cariprazine)用於治療成人精神分裂症與躁鬱症(bipolar disorder)。VraylarTM為一個口服的5-HT1A受體與多巴胺D2受體局部活化劑、5-HT2A受體拮抗劑,由匈牙利的Gedeon Richter公司所研發,於2012年將VraylarTM美國和加拿大的開發權轉讓給Forest Laboratories公司。在為期6週共1,754位受試者的3個臨床試驗中,VraylarTM被證實能有效減輕精神分裂症患者的精神症狀,常見的不良反應為錐體外症候群(extrapyramidal symptoms),如震顫、言語不清和不自主的肌肉動作;另外,在為期6週共1,037位受試者的3個臨床試驗中,VraylarTM亦被證實具有減輕躁鬱症症狀的效果,其常見的副作用包括靜坐不能(akathisia)、消化不良(dyspepsia)、嘔吐、睏倦 (somnolence)及不安(restlessness)等錐體外症候群。如同其他已獲U.S. FDA核准用於治療精神分裂症與躁鬱症的藥物,VraylarTM亦帶有黑框警告,提醒該藥會增加老年失智症患者的死亡風險,且此藥物未被核准用於此類患者的治療。
2015年9月17日U.S. FDA 核准Allergan公司的VraylarTM(cariprazine)用於治療成人精神分裂症與躁鬱症(bipolar disorder)。VraylarTM為一個口服的5-HT1A受體與多巴胺D2受體局部活化劑、5-HT2A受體拮抗劑,由匈牙利的Gedeon Richter公司所研發,於2012年將VraylarTM美國和加拿大的開發權轉讓給Forest Laboratories公司。在為期6週共1,754位受試者的3個臨床試驗中,VraylarTM被證實能有效減輕精神分裂症患者的精神症狀,常見的不良反應為錐體外症候群(extrapyramidal symptoms),如震顫、言語不清和不自主的肌肉動作;另外,在為期6週共1,037位受試者的3個臨床試驗中,VraylarTM亦被證實具有減輕躁鬱症症狀的效果,其常見的副作用包括靜坐不能(akathisia)、消化不良(dyspepsia)、嘔吐、睏倦 (somnolence)及不安(restlessness)等錐體外症候群。如同其他已獲U.S. FDA核准用於治療精神分裂症與躁鬱症的藥物,VraylarTM亦帶有黑框警告,提醒該藥會增加老年失智症患者的死亡風險,且此藥物未被核准用於此類患者的治療。(3) Aristada® (aripiprazole lauroxil)
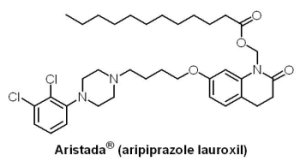 Alkermes公司用於治療精神分裂症成人患者的緩釋注射劑Aristada® (aripiprazole lauroxil)於2015年10月6日獲核准上市。Aristada® 亦為一個5-HT1A受體與多巴胺D2受體局部活化劑、5-HT2A受體拮抗劑,每4至6週由專業護理人員於患者手臂或臀部注射一次。Aristada® 是Alkermes公司應用自家LinkeRx技術所開發的藥物,為一個新脂質前驅藥(prodrug),於人體內會轉變成aripiprazole,為Otsuka公司的精神分裂症口服治療藥物Abilify® (aripiprazole)之主要成分。於一項為期12週共622位受試者的臨床試驗結果顯示,經服用aripiprazole而穩定的急性精神分裂症患者,可以Aristada® 維持治療效果;常見的不良反應為靜坐不能。如同上述兩個藥物,Aristada® 亦帶有黑框警告,提醒該藥未被核准用於老年失智症的治療,且此藥物會增加此類患者的死亡風險。
Alkermes公司用於治療精神分裂症成人患者的緩釋注射劑Aristada® (aripiprazole lauroxil)於2015年10月6日獲核准上市。Aristada® 亦為一個5-HT1A受體與多巴胺D2受體局部活化劑、5-HT2A受體拮抗劑,每4至6週由專業護理人員於患者手臂或臀部注射一次。Aristada® 是Alkermes公司應用自家LinkeRx技術所開發的藥物,為一個新脂質前驅藥(prodrug),於人體內會轉變成aripiprazole,為Otsuka公司的精神分裂症口服治療藥物Abilify® (aripiprazole)之主要成分。於一項為期12週共622位受試者的臨床試驗結果顯示,經服用aripiprazole而穩定的急性精神分裂症患者,可以Aristada® 維持治療效果;常見的不良反應為靜坐不能。如同上述兩個藥物,Aristada® 亦帶有黑框警告,提醒該藥未被核准用於老年失智症的治療,且此藥物會增加此類患者的死亡風險。註1:Novel New Drugs 2014 Summary; Novel Drugs 2015 Summary. www.fda.gov/drugs
註2:《國家衛生研究院電子報—新藥再創新猷-漫談2015年美國FDA核准小分子新藥(上)。第659期》,生技與藥物研究所謝興邦研究員、李靜琪副研究員。
《文/圖:生技與藥物研究所謝興邦研究員、李靜琪副研究員;審校:生技與藥物研究所陳炯東研究員》