NHRI Communications

研究發展
吲哚胺2,3-雙加氧酶(IDO1)抑制劑用於癌症免疫治療之研發現況
Utilization of IDO1 inhibitor in cancer immunotherapy
 在現代化社會中,癌症已經成為全世界主要死因之一,根據世界衛生組織(WHO)的資料,2012年,癌症全球新增1,410萬病例,有820萬人死於癌症,推估20年之後,全球每年將有2,200萬新增的癌症病例。在台灣,癌症造成的死亡率亦是逐年攀升,持續高居國人十大死因之首位。除了毒殺細胞的化療藥物與癌症分子標靶治療,近年來癌症免疫治療也逐漸成為癌症有效療法之一。最近出版的一份針對全球及美國癌症免疫治療的市場分析資料指出,到2020年,癌症免疫療法產值將達800億美元,預期此類型治療方式在未來具有高度發展性。
在現代化社會中,癌症已經成為全世界主要死因之一,根據世界衛生組織(WHO)的資料,2012年,癌症全球新增1,410萬病例,有820萬人死於癌症,推估20年之後,全球每年將有2,200萬新增的癌症病例。在台灣,癌症造成的死亡率亦是逐年攀升,持續高居國人十大死因之首位。除了毒殺細胞的化療藥物與癌症分子標靶治療,近年來癌症免疫治療也逐漸成為癌症有效療法之一。最近出版的一份針對全球及美國癌症免疫治療的市場分析資料指出,到2020年,癌症免疫療法產值將達800億美元,預期此類型治療方式在未來具有高度發展性。近年來,癌症免疫療法在治療黑色素瘤上表現亮眼的有:必治妥施貴寶(Bristol-Myers Squibb)公司研發的CTLA-4抑制劑益伏(Yervoy)、默克藥廠開發的PD-1/PD-L1的抑制劑Keytruda,以及今年5月剛獲得美國食品藥物管理局(FDA)核准用於膀胱癌治療由羅氏(Roche)藥廠開發的PD-1/PD-L1抑制劑Tecentriq;以上均使用單株抗體作為免疫檢查點(immune checkpoint)的抑制劑,因而成為癌症免疫治療藥物。
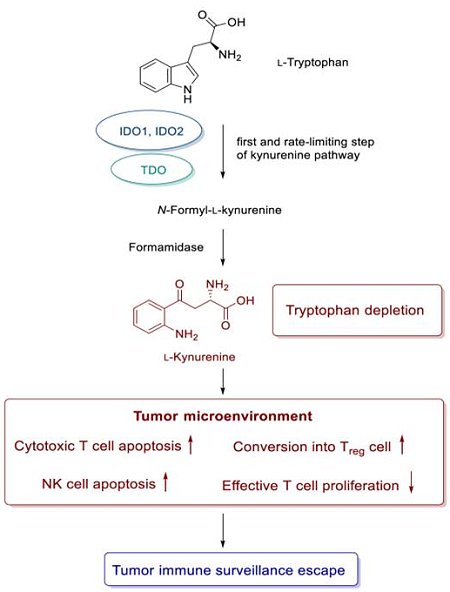 除了單株抗體,在小分子藥物領域中,吲哚胺2,3-雙加氧酶(indoleamine 2,3-dioxygenase 1, IDO1)近年來被認為是一個新穎的癌症免疫治療標的。IDO1以及IDO2與色氨酸2,3-雙加氧酶(tryptophan 2,3-dioxygenase, TDO)這3種酵素為代謝必需胺基酸色氨酸(tryptophan)的重要酵素,他們同為犬尿氨酸(kynurenine)途徑的第一與速率決定步驟(rate-limiting step)之限速酶。在犬尿氨酸途徑中,色氨酸經過代謝生成多種具生物活性的代謝物,其中包括犬尿氨酸。在腫瘤的微環境(microenvironment)中,色氨酸代謝為犬尿氨酸後會降低T細胞的增殖能力,也會使得樹突細胞(dendritic cell)將naïve CD4+ T細胞轉化為調節型之T細胞(T regulatory cells, Tregs)。這兩個主要的影響皆會使得主體(host)的免疫能力受到抑制,讓腫瘤細胞可以從免疫監控(immune surveillance)中逃脫(escape),而增加腫瘤細胞的免疫耐受性(圖一)。
除了單株抗體,在小分子藥物領域中,吲哚胺2,3-雙加氧酶(indoleamine 2,3-dioxygenase 1, IDO1)近年來被認為是一個新穎的癌症免疫治療標的。IDO1以及IDO2與色氨酸2,3-雙加氧酶(tryptophan 2,3-dioxygenase, TDO)這3種酵素為代謝必需胺基酸色氨酸(tryptophan)的重要酵素,他們同為犬尿氨酸(kynurenine)途徑的第一與速率決定步驟(rate-limiting step)之限速酶。在犬尿氨酸途徑中,色氨酸經過代謝生成多種具生物活性的代謝物,其中包括犬尿氨酸。在腫瘤的微環境(microenvironment)中,色氨酸代謝為犬尿氨酸後會降低T細胞的增殖能力,也會使得樹突細胞(dendritic cell)將naïve CD4+ T細胞轉化為調節型之T細胞(T regulatory cells, Tregs)。這兩個主要的影響皆會使得主體(host)的免疫能力受到抑制,讓腫瘤細胞可以從免疫監控(immune surveillance)中逃脫(escape),而增加腫瘤細胞的免疫耐受性(圖一)。圖一:色氨酸經犬尿氨酸途徑代謝生成犬尿氨酸,與腫瘤細胞藉由表達IDO1蛋白從免疫監控逃脫之主要因素
上述3種酵素在組織分布及功能上有所不同,TDO主要表達於肝臟,維持體內色氨酸的平衡,因此,起初科學家們並不認為TDO可以作為癌症免疫治療的標的,然而近幾年部份研究顯示,TDO在少數幾類腫瘤中會有過度表現的狀況,因此TDO也逐漸被認為可作為癌症免疫治療的標的之一,但相關研究仍在起步階段;目前與IDO2相關的研究仍相當缺乏,主要是由於在實驗室中要表現與純化IDO2仍有不少困難,因此僅瞭解其表現程度與活性均不如IDO1;而IDO1表現於非肝臟組織,也會在發炎時引發表現。
發炎時不僅會引發IDO1表現,在臨床研究中也發現許多人類腫瘤會表現IDO1(如攝護腺癌、胃癌、結腸直腸癌、胰腺癌、膠質母細胞瘤和非小細胞肺癌),而IDO1的表現往往也與癌症的預後不良相關。在不同類型的癌症患者,包括乳癌、大腸直腸癌、頭頸癌及肺癌等,不僅出現IDO1的過度表現現象,其血中之犬尿氨酸/色氨酸之比例也遠高於健康者。因此,IDO1在這個領域發展之初被認為是調控犬尿氨酸途徑作為癌症免疫治療的分子標靶。
由於IDO1的表現與腫瘤細胞的免疫耐受性之強烈關聯性,使得越來越多團隊致力於研發IDO1抑制劑,綜觀目前研發的IDO1抑制劑,包含有色氨酸類似物、天然物以及具備各種核心結構的非天然物,其中已有3個進入臨床試驗(參考 http://www.clinicaltrials.gov)。由Incyte公司研發的Epacadostat(INCB024360)目前進入臨床III期,也是發展得最前端的小分子抑制劑。由於Epacadostat在安全性方面有良好的耐受性(口服1日兩劑700毫克/劑,仍未達最大耐受劑量,參考http://www.incyte.com),與在臨床I期試驗的報告呈現對於延緩腫瘤生長進程的良好反應,吸引了許多藥廠像是必治妥施貴寶、默克、阿斯特捷利康(AstraZeneca)、基因泰克(Genetech)與Incyte進行臨床試驗的合作,主要是合併Epacadostat與其他免疫檢查點抑制單株抗體、激酶(kinase)抑制劑使用。
由Newlink公司研發,後來技轉給基因泰克的GDC-0919目前也進入臨床I期試驗,包括單一藥物治療及與羅氏藥廠開發的PD-1/PD-L1抑制劑Tecentriq合併治療之試驗。而同樣由Newlink公司所發展的另一個藥物Indoximod,則有數個臨床I期或II期試驗是與癌症治療疫苗(cancer treatment vaccine)、癌症標靶藥物、化療藥物、或是免疫檢查點抑制單株抗體合併治療的試驗在進行中。此外,也有數個由小型生技公司或是小型藥廠所研發,後續與大藥廠合作的藥物正在臨床前試驗階段(表一)。從這些合作案研究的方向可以發現,調控犬尿氨酸途徑作為癌症免疫治療分子標靶的策略,已經逐漸從單一選擇性IDO1抑制劑轉變為IDO1與TDO雙標靶抑制劑,甚至是單一選擇性TDO抑制劑。在IDO1抑制劑的研發方興未艾之際,各方都期待看到一個小分子IDO1抑制劑可以在臨床III期試驗獲得有效的結果,藉此驗證IDO1可以作為癌症免疫療法的標靶。
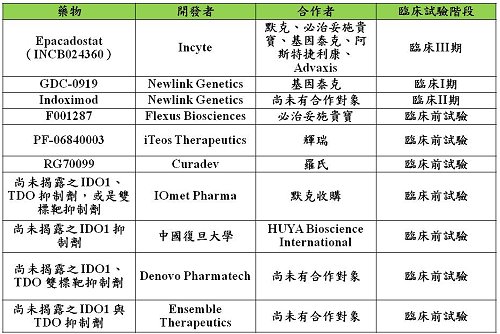
表一:IDO1、TDO或是雙標靶抑制劑的研發狀況
本院生技與藥物研究所(以下簡稱生藥所)從2010年啟動IDO1抑制劑的新藥研發計畫,在過去幾年中發展出對IDO1酵素的活性有良好的抑制能力一系列phenyl benzenesulfonyl hydrazide類的化合物,在同源小鼠CT26腫瘤模式中,以口服400毫克/公斤、1日投兩次藥,也有顯著的腫瘤生長抑制效果(TGI = 73%,day18)。此外,在生藥所結構生物學伍素瑩博士的研究中,成功解析GDC-0919其中一個衍生物IDO1蛋白的共結晶結構,以及數個生藥所發展的另一個系列的抑制劑與IDO1蛋白的共結晶結構,這些資訊將有助於IDO1抑制劑的研發(圖二)。以上兩項成果均發表於今年的Journal of Medicinal Chemistry。[註]
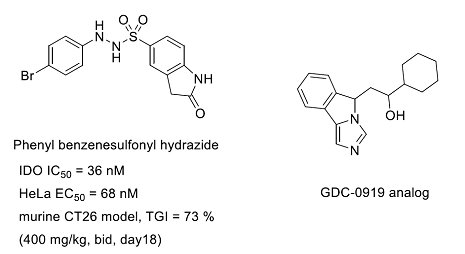
圖二:本院生技與藥物研究所研發之phenyl benzenesulfonyl hydrazide類的IDO1抑制劑;與解析出與IDO1蛋白共結晶結構之GDC-0919的衍生物
[註]:
- Lin, S.-Y. et al. Phenyl benzenesulfonylhydrazides exhibit selective indoleamine 2,3-dioxygenase inhibition with potent in vivo pharmacodynamic activity and antitumor efficacy. Journal of Medicinal Chemistry 2016, 59, 419.
- Peng, Y.-H. et al. Important hydrogen bond networks in indoleamine 2,3-dioxygenase 1 (ido1) inhibitor design revealed by crystal structures of imidazoleisoindole derivatives with IDO1. Journal of Medicinal Chemistry 2016, 59, 282.
《文/圖:生技與藥物研究所翁紹華助研究員》