NHRI Communications

研究發展
人類誘導性多功能幹細胞衍生之間質幹細胞具有低致癌性及調控異常免疫反應的應用潛力
NHRI researchers report differentiation of MSCs from hESCs results in downregulation of c‐Myc and DNA replication pathways with immunomodulation toward CD4 and CD8 cells
 人類的間質幹細胞(mesenchymal stem cells, MSCs)是一種具有多分化潛力及免疫調控能力的成體幹細胞,故擁有高度臨床應用性;但其數目在體內較為稀少,而幹細胞治療則需要較多的細胞數目(每次約需108∼1010細胞),因此,MSCs取得後皆需在體外培養至相當的細胞數量才能達到臨床使用需求。但這個體外培養的過程,往往會產生複製性衰老(replicative senescence)而降低幹細胞的增殖、分化及免疫調控功能,此為MSCs在臨床應用上的一大瓶頸。
人類的間質幹細胞(mesenchymal stem cells, MSCs)是一種具有多分化潛力及免疫調控能力的成體幹細胞,故擁有高度臨床應用性;但其數目在體內較為稀少,而幹細胞治療則需要較多的細胞數目(每次約需108∼1010細胞),因此,MSCs取得後皆需在體外培養至相當的細胞數量才能達到臨床使用需求。但這個體外培養的過程,往往會產生複製性衰老(replicative senescence)而降低幹細胞的增殖、分化及免疫調控功能,此為MSCs在臨床應用上的一大瓶頸。因此,如果利用與人類胚胎幹細胞(human embryonic stem cells, hESCs)相似具高度增生能力,但又可「客製化」的人類誘導性多功能幹細胞(induced pluripotent stem cells, iPSCs)作為細胞材料來源,將其源源不絕地衍生出下游的MSCs,則不但可以解決成體幹細胞體外培養會衰老的問題,同時因已分化至MSCs,故也可避開直接使用iPSCs及hESCs可能在體內會產生畸胎瘤(teratoma)的疑慮。然而,目前對於iPSCs所衍生的MSCs(iPSC-MSCs)是否具備所有MSCs之功能,尤其是免疫抑制的能力則還不甚確定。
之前,本院細胞及系統醫學研究所顏伶汝研究員級主治醫師的團隊已成功建立多株台灣本土的人類iPSCs,此次則是經由顏醫師、本院癌症研究所劉柯俊研究員及感染症與疫苗研究所司徒惠康特聘研究員兼副院長共同合作發現,不論人類iPSC-MSCs是使用何種再程序化方式(reprogramming method)何種細胞來源(cell source)得到的iPSCs,其所衍生出來的MSCs都具有多分化潛力。而且,它們的免疫調控能力與骨髓間葉幹細胞及由hESCs衍生而來的MSCs(hESC-MSCs)相較並無差異。此研究成果已發表於2018年2月的《Stem Cells》期刊 (2018 Feb 3. doi: 10.1002/stem.2795)。
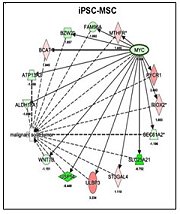
該研究主要是利用顏醫師實驗室之前建立的4株iPSCs(包括2株由「人類疾病誘導型多潛能幹細胞服務聯盟資源中心」所支持發展的iPSCs),將其分化至MSCs,再與2株hESC-MSCs以及3株成體骨髓來源的MSCs(BM-MSCs)比較,結果發現:當iPSCs分化成MSCs後,不但沒有形成畸胎瘤的問題,其致癌基因c-Myc(也是reprogramming的基因之一)的表現,與hESC-MSCs及BM-MSCs一樣也都下降(圖1(A)),這顯示iPSC-MSCs的分化會移除母細胞iPSCs的癌化風險。至於在免疫調節方面,結果也顯示這9株不同來源的MSCs都可在體外實驗中,顯著地抑制人類T淋巴細胞的活化(圖1(B)和1(C));包括減少CD4 T細胞的Th1及Th17亞群和CD8毒殺性細胞Tc1及Tc17亞群的比率,也會增加具免疫抑制功能的調節性T細胞(Tregs)。如果進一步利用發炎的小鼠動物模式,一樣也會發現這9株不同來源的MSCs,都可顯著地抑制T淋巴細胞的活化(圖1(D))。
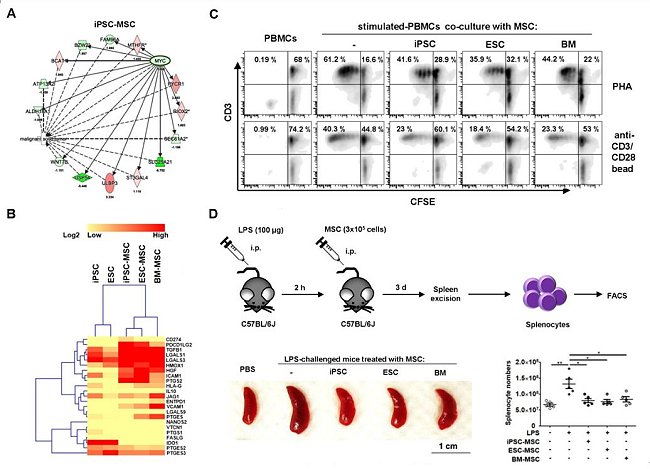
圖1:(A)將人類誘導性多功能幹細胞(induced pluripotent stem cells, iPSCs)分化成MSCs(iPSC-MSCs)後,致癌基因c-Myc及其下游的基因偏向低度表達;(B) iPSC-MSCs高度表達會抑制T細胞活性的分子;(C)利用非專一性(PHA)及專一性(anti-CD3/CD28 bead)的T細胞刺激物,活化已以CFSE螢光物質標記的T細胞,可看到T細胞快速分裂因而減少CFSE含量。藉此評估平台,將之與iPSC-MSCs、ESC-MSCs及BM-MSCs共同培養,發現都可有效抑制T細胞的活化;(D)利用脂多醣(LPS)造成發炎的小鼠動物模式後,再透過給予iPSC-MSCs、ESC-MSCs及BM-MSCs細胞,發現也都可達到有效抗發炎的結果
綜合上述結果總結顯示,以不同再程序化的方法或不同來源的細胞所獲致的iPSCs,再將其分化得到的MSCs,不僅能夠移除癌化風險,還能具有多分化及免疫調節能力(圖2)。這將使未來的研究在臨床上,能夠透過iPSCs的技術平台提供個人化、高均質性、足夠數量的iPSC-MSCs應用在再生醫學及免疫疾病的治療。
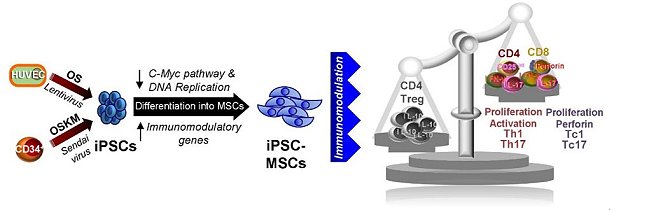
圖2:利用不同再程序化方法所得到的iPSCs在分化成MSCs後,不僅具有低癌化風險,且有調節T淋巴細胞的能力
《文/圖:細胞及系統醫學研究所王麗姿博士後研究員、顏伶汝研究員級主治醫師、癌症研究所劉柯俊研究員、感染症與疫苗研究所司徒惠康特聘研究員兼副院長》