NHRI Communications

健康知識
生命的奧祕:發現不連續基因 --1993年諾貝爾生理醫學獎譯文
The discovery of "Split Genes" -- The Nobel Prize in Physiology and Medicine 1993
 摘要
摘要過去四十年來,由於分子生物學領域的蓬勃發展,使我們對遺傳物質--基因--有大幅瞭解。起初十年,基因的研究主要集中於簡單的生物體,尤其是細菌及噬菌體。在1977 年之前,所有人都認為基因是DNA上一個連續性(continuous)的片段,直到羅伯茲(Richard John Roberts)和夏普(Phillip Allen Sharp)分別發現基因可由DNA上不連續的幾個完整片段組成。羅伯茲和夏普使用引起普通感冒的病毒--腺病毒(adenovirus),作為他們的實驗模型系統。因為腺病毒的基因組(genome)和高等生物的基因組有許多相似之處。不久之後,數個研究報導也指出不連續基因在高等生物體很常見,其中包括人類。
羅伯茲和夏普的發現使我們對於高等生物基因發展的演化改變了觀點。不連續基因的發現也使科學家預測出新的遺傳學過程-剪裁 (splicing)--在遺傳訊息的表達為必要的。不連續基因的發現奠定了現代生物學、癌症和其他疾病發展的基礎醫學研究之重要基礎。
遺傳物質
在過去四十年期間, 我們對遺傳物質--基因--如何支配基本的生命現象有大幅的瞭解。此需歸功於科學家在分子生物學領域裡探討分子層面的生物現象與結構的進展。很多在這領域有重大發現的科學家都已受頒諾貝爾獎的殊榮。例如,發現遺傳化學物質--DNA--的結構組成 (1962)、核酸的合成 (synthesis) (1959)、基因之活性調控 (1965) 和遺傳密碼的表現與詮釋 (1968)等。這些知識發展主要集中於研究簡單的生物體,如細菌及噬菌體。
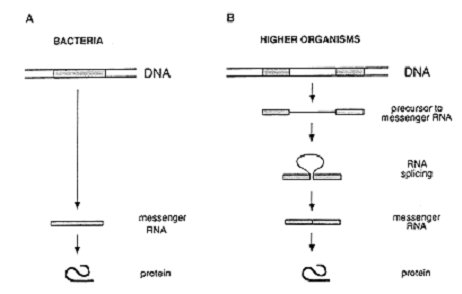
在1970年代中期,普遍對於遺傳物質與作用盛行的概念可總結如下:基因是存在於一列長條雙股DNA分子上的一個連續性(continuous)片段。當基因被活化時,它的資訊就會被轉錄成單股的RNA分子,稱為信使RNA (messenger RNA,mRNA),由此再將資訊再轉譯 (translate) 成蛋白質。(圖1A)
到了1977年,這個簡單的觀點有了徹底地改變。美國紐約長島冷泉港實驗室的羅伯茲和劍橋麻省理工學院的夏普兩人發現了基因可由不只一個,而是數個被不相干的DNA (irrelevant DNA) 所分隔開的DNA片段組合而成 (圖1B)。而這樣的不連續基因也存在於高等生物體之中。
[圖一(右上): 細菌 (A) 和高等生物體 (B) 的基因結構與遺傳資訊的流向。細菌的遺傳資訊儲存於一個連續的DNA片段上,蛋白質可直接被相對應的信使RNA轉譯合成。但高等生物體的基因通常是不連續的,信使RNA在轉譯合成蛋白質之前必須先經過剪裁過程。]
實驗的發現
羅伯茲和夏普使用引起普通感冒的病毒--腺病毒 (adenovirus)--作為他們的研究遺傳物質的實驗系統。因腺病毒可感染高等生物的細胞,結構相當簡單,且腺病毒的基因組(genome)和高等生物宿主細胞的基因組有許多相似之處,因此腺病毒是研究高等生物體基因與功能,極具價值的實驗模型。腺病毒的基因組是由一列長條的DNA分子組成。羅伯茲和夏普的研究目標在於確定每一個基因在基因組裡的所在位置。
生化實驗顯示,在腺病毒mRNA的一端出現與預期不同的結果。幾種可能的解釋是,與此端相對應的DNA片段,並沒有直接緊鄰其餘的基因。為了確定這個片段在這長條DNA分子上的位置,他們用電子顯微鏡來作觀察並驚訝地發現,與這一列RNA分子相對應的DNA分子,是由不只四個完全分離的DNA片段所組成 (圖2)。羅伯茲和夏普因此推論:在基因組裡,基因裡的遺傳訊息是由不連續地DNA片段所組成。此結論與過去對基因結構普遍的觀點相牴觸。隨之掀起了密集的研究,科學家急欲探討這種基因結構是否也出現在其他病毒和一般的細胞裡。不久之後,幾個研究報告指出,這種不連續基因結構很常見。事實上,此現象普遍存在高等生物體裡。
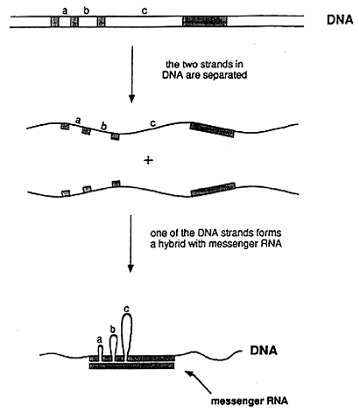 [圖二: 說明腺病毒DNA含有不連續基因之圖解。mRNA裡的遺傳資訊存在由三個中介區域 (a、b、和 c) 所分隔的四個DNA片段上。實驗產生的單股DNA與RNA之間的雜合 (hybrid)分子,在單股DNA上介於基因中間的區域片段會形成圈環 (loop) ,即表示RNA序列上缺少對應部分。這個雜合分子可直接在電子顯微鏡下觀察。]
[圖二: 說明腺病毒DNA含有不連續基因之圖解。mRNA裡的遺傳資訊存在由三個中介區域 (a、b、和 c) 所分隔的四個DNA片段上。實驗產生的單股DNA與RNA之間的雜合 (hybrid)分子,在單股DNA上介於基因中間的區域片段會形成圈環 (loop) ,即表示RNA序列上缺少對應部分。這個雜合分子可直接在電子顯微鏡下觀察。]此發現的重要性
此新發現顯示一個基因可能包含數個片段,通常稱之為外顯子 (exons) ,被介於中間的內含子 (introns) DNA所分隔。這項認知徹底地改變我們對於演化過程中遺傳物質發展的看法。長期以來,普遍的觀念認為演化的發生是由於遺傳物質中細微改變(突變)不斷的累積,所以導致漸進式的演化。
有鑑於科學家發現基因以不連續型態出現,高等生物體的演化除了突變,還可能利用另外的機制:重組 (rearrangement or shuffling) 基因片段形成新的功能單位 (functional units) 來加速演化過程。像在生殖細胞 (germ cells)裡,染色體配對時進行的基因互換 (crossing-over)。此假說更吸引人的是,隨後發現在數個例子裡,外顯子(exons)與蛋白質的結構模組 (building modules)--即能表現特定功能的區塊 (domains) 相互對應。也就是說,基因組裡的外顯子與蛋白質裡特定的次級功能 (subfunction) 相對應,外顯子的重新排列因而也形成蛋白質次級功能的新組合。這種重新排列特定功能模組的過程,大幅提升演化進展。
基因可由兩個或多個片段所組成,此發現馬上引起進一步的推測,其結果令人驚訝且具重要性:在最初轉錄的RNA產物裡,有外顯子和內含子的序列;必須經過 "編輯(edited)" 的過程,裁除內含子的序列讓其餘的外顯子序列結合在一起,形成一個變短的RNA分子。現在科學家已證實這個過程,且我們已經對此過程的相關性質累積具體資訊。這個過程叫做剪裁 (splicing);相較於低等生物體,對高等生物體來說, 這代表了一種資訊傳導的添加步驟 (圖1B)。當在最終合成的RNA分子裡發現組合的外顯子片段並不完全相同之後,「剪裁」的重要性更加顯而易見。隨著不同組織或發展階段,不同組合的外顯子結合可以表現不同的mRNA分子。因此,一樣的DNA區域在許多例子裡會決定出許多不一樣的蛋白質結構。這個過程稱為選擇性剪裁(alternative splicing),並且代表著一個新的基礎原理:遺傳訊息 (genetic message) 衍生的獨特產物,並不一定在RNA初合成時就已確立;而是剪裁的樣式(splicing pattern) 決定最終產物的性質 (the nature of the final product)。
醫學觀點
遺傳性疾病是常見的,現今的估計其數目超過5000種。其中有些是由於剪裁(splicing) 過程發生錯誤。研究得最多的代表性疾病為β-地中海貧血症(beta-thalassemia),是一種盛行於某些部分地中海國家的貧血症 (anemia)。
β-地中海貧血症 (beta-thalassemia)是一種由錯誤的蛋白質所造成的疾病。β-血紅蛋白 (beta-globin)形成紅血球細胞裡血紅素的一部份,如果形成無用或有功能缺陷的β-血紅蛋白,紅血球的生命週期將因此縮短而造成貧血。不同的病人體內可發現不同的遺傳物質小缺陷,這些缺陷導致剪裁過程中發生錯誤,而合成出功能不佳的β-血紅蛋白。圖3A顯示β-血紅蛋白RNA的正常剪裁。圖3B 顯示如果β-血紅蛋白基因受到損害(箭頭標示),有可能導致剪裁過程失誤而形成較大的外顯子片段,或者像圖3C 所顯示形成一個全新的外顯子。
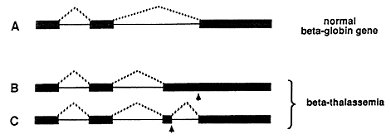 [圖三: 缺陷不良的剪裁過程導致β-地中海貧血症。正常的β-血紅蛋白基因如圖3A所示,而另兩個導致β-地中海貧血症的突變基因如圖B與C所示。箭頭標示單點突變(point mutations) 的位置。虛線是預示剪裁過程中會被結合一起的片段。在一個健康的個體裡,剪裁過的片段如圖A所示。在某個地中海貧血症案例裡,一個非常長的第三片段被形成 (B),而在另一個案例裡,則是完全多了一個片段 (C)。]
[圖三: 缺陷不良的剪裁過程導致β-地中海貧血症。正常的β-血紅蛋白基因如圖3A所示,而另兩個導致β-地中海貧血症的突變基因如圖B與C所示。箭頭標示單點突變(point mutations) 的位置。虛線是預示剪裁過程中會被結合一起的片段。在一個健康的個體裡,剪裁過的片段如圖A所示。在某個地中海貧血症案例裡,一個非常長的第三片段被形成 (B),而在另一個案例裡,則是完全多了一個片段 (C)。]另一個顯示疾病與遺傳物質裡的外顯子和內含子組成有關連的例子是慢性骨髓性白血病 (chronic myeloic leukemia),血癌的一種。這疾病的特徵是在腫瘤細胞內存在一種特殊且縮短的染色體,此以發現它的實驗室所在城市命名,稱之為費城染色體 (Philadelphia chromosome)。這個染色體出現在白血球細胞內,是由體內第22及第9號染色體的兩端融合而成。在斷裂點 (break-point) 上,有一癌基因的一大部分會與另一個基因結合。因此,我們需面對兩個基因所融合出來的一個RNA分子。兩個基因的外顯子經過剪裁過程形成一個RNA分子,然後轉譯合成出一種新的蛋白質,稱為融合蛋白質 (fusion protein)。這個蛋白質進而造成白血病。
參考文獻
原文:瑞典諾貝爾獎基金會 The Nobel Assembly at the Karolinska Institute
《文:編輯中心劉盈秀譯;審稿:學發處張素芝博士;圖:瑞典諾貝爾獎基金會》