NHRI Communications

研究發展
抗腸病毒藥物研發
NHRI researchers investigate the synergistic inhibition of Enterovirus 71 replication by interferon and rupintrivir
腸病毒屬小RNA病毒科(Picornaviridae)由近70種不同血清型所組成,主要包括小兒麻痺病毒(poliovirus)、柯薩奇病毒A、B型(coxackievirus)、伊科病毒(echovirus)以及腸病毒68-71型。腸病毒典型症狀為口腔、手掌、腳掌出現水泡與潰瘍,即手口足症(hand-foot-mouth disease)及泡疹性咽峽炎(herpangina),並可能合併發燒;少數個案會發生無菌性腦膜炎、腦炎、心肌炎、心包膜炎、麻痺死亡等併發症,於感染發病後的一週內傳染力最強。腸病毒屬於季節性的流行疾病,在人口稠密、環境濕熱的亞洲國家,經常爆發嚴重的流行感染。台灣於1998年發生腸病毒71型大流行,當時造成約129,106幼童染病,其中4百多名5歲以下幼兒有嚴重症狀,超過78名孩童死亡。中國大陸於2010年亦爆發一波大流行,造成15,501人嚴重感染,537名孩童死亡。每年腸病毒重症皆有造成嬰幼兒死亡的案例發生,足見腸病毒的感染威力不容忽視。由於RNA病毒具有高度變異之特性,至今仍無有效治療之藥物。再者由於腸病毒藥物的經濟規模對藥廠不具吸引力,而針對兒童疾病的新藥研發更有許多可預知的困難。
本院生技藥研所徐祖安研究員、洪慧貞博士後研究員與長庚大學施信如教授實驗室之研究團隊,嘗試從老藥以及已完成 phase II或III臨床試驗的實驗用藥中尋找答案。研究團隊為瞭解為何有廣效性抗病毒活性的干擾素(interferon-α, IFN-α)不能有效抑制腸病毒的複製,經過相關實驗結果發現,腸病毒複製會降低受干擾素調控之干擾素反應片段(interferon stimulated response element, ISRE)的下游基因表現,因而再進一步探討病毒可能對抗宿主細胞之作用機轉。腸病毒的2A與3C蛋白酶除了負責切割病毒本身的複蛋白外,亦切割一些細胞內的蛋白質,而影響細胞內轉錄與轉譯作用之進行。有鑑於此,該團隊嘗試探究先天性免疫(innate immunity)中的第一型干擾素訊息傳遞路徑相關因子是否也受到病毒蛋白酶的影響。結合生物資訊學與蛋白質體學之有效分析與驗證,有助於了解病毒與宿主免疫系統之交互關係,用以提供有效的抗病毒策略。
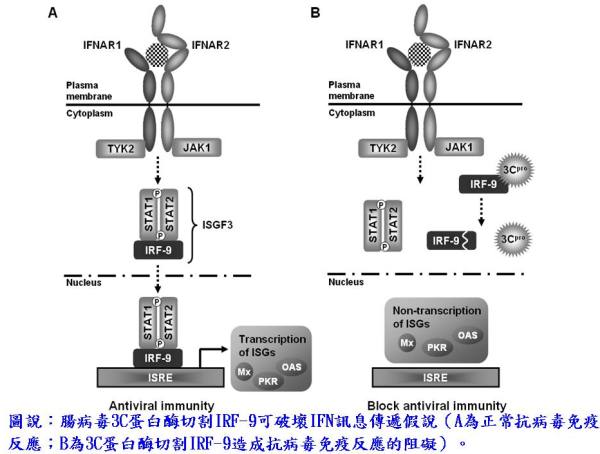
此研究先以生物資訊學的方法預測病毒蛋白酶在宿主細胞內的可能切割受質,於National Center for Biotechnology Information (NCBI)的Online Mendelian Inheritance in Man (OMIM)資料庫中篩選出330個與干擾素相關的蛋白質,再利用NetPicoRNA分析網站預測是否為2A或3C蛋白酶的可能切割受質。由預測分析結果中得知,有158個干擾素相關蛋白質可能具有3C蛋白酶的切割位點、有19個干擾素相關蛋白質可能具有2A蛋白酶的切割位點;其中共有16個可能切割受質同時具有2A與3C蛋白酶的切割位點。由細胞株感染腸病毒與目標物重組蛋白質與3C蛋白酶in vitro切割等實驗結果顯示,interferon regulatory factor-9 (IRF-9)的確為3C蛋白酶之切割受質。IRF-9已知與第一型干擾素產生抗病毒機制有關,IRF-9經活化後可正向調控STAT1與STAT2,並與其形成ISGF3複合物,進而活化IFN-α及IFN-β(圖A)。相關文獻亦指出破壞IRF-9功能可阻止IFN訊息傳遞,而在此訊息傳遞路徑的主要相關蛋白質並不會受腸病毒蛋白酶之影響,上述實驗結果或許能解釋為何腸病毒可輕易躲開IFN授予宿主細胞的抗病毒機制(圖B)。
Agouron Pharmaceuticals Inc.已被輝瑞大藥廠(Pfizer Inc.)併購,其曾針對造成普通感冒的鼻病毒(rhinovirus)開發了鼻病毒的3C蛋白酶抑制劑rupintrivir (AG7088)(臨床二期終止)。Rupintrivir已被證實亦能抑制腸病毒的3C蛋白酶,故研究團隊更進一步評估合併蛋白酶抑制劑rupintrivir與細胞激素IFN-α之抗腸病毒效果,結果顯示蛋白酶抑制劑可有效回復細胞因被感染而遭到干擾的IFN抗病毒機制,這部分的成果刊登於今年6月份的Journal of Infectious Diseases (2011;203(12):1784-90)。由於IFN-α為臨床用藥,而rupintrivir曾於人體臨床試驗中證實為安全的實驗用藥,此項研究成果將提供腸病毒藥物治療可能之捷徑。
《文/圖:生技藥研所洪慧貞博士後研究員、工研院生醫所王翔靖副研究員(前長庚大學施信如教授之研究團隊);校稿:生技藥研所徐祖安研究員、長庚大學施信如教授》