NHRI Communications

院務紀事
本院國防研發替代役役男施佑宗榮獲徐千田優秀論文頭等獎
Draftee Yu-Tsung Shin of R&D Substitute Service wins First Prize of Dr. Chien-Tien Hsu's Science Award
 本院細胞及系統醫學研究所裘正健研究員所指導之國防研發替代役役男施佑宗,參加2013年1月30日至2月1日於墾丁悠活麗緻渡假村舉辦之「第21屆細胞及分子生物新知研討會」,以「Vascular niche-mediated plasticity of circulating endothelial progenitor cells in hepatocarcinoma progression」為題,榮獲頭等獎,並頒發獎金新台幣二萬元整。
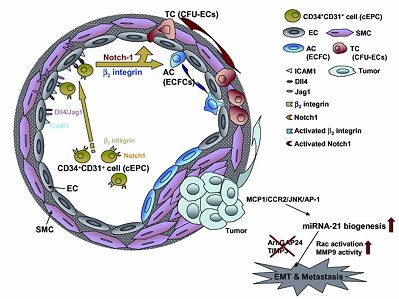
本院細胞及系統醫學研究所裘正健研究員所指導之國防研發替代役役男施佑宗,參加2013年1月30日至2月1日於墾丁悠活麗緻渡假村舉辦之「第21屆細胞及分子生物新知研討會」,以「Vascular niche-mediated plasticity of circulating endothelial progenitor cells in hepatocarcinoma progression」為題,榮獲頭等獎,並頒發獎金新台幣二萬元整。施佑宗目前主要研究重點在探討人類周邊血液中的內皮先驅細胞(circulating endothelial progenitor cells, cEPC),在血管壁微環境(vascular niche)交互作用下,調節其移動性及相關分化潛能,並進一步參與動脈硬化(atherosclerosis)及肝癌惡性轉移之相關分子機制。此研究結果提供新的動脈硬化或癌症細胞標靶方向,並加速與其相關之細胞療法發展。施佑宗於此次大會提出近來之實驗結果,並與與會人員分享研究心得和經驗,其摘要如下:
內皮先驅細胞的招募(recruitment)及分化潛能對於心血管疾病與癌症新生血管之發展具有高度的關聯性,然而仍未明瞭的是細胞微環境(cellular microenvironment)對內皮先驅細胞的潛能特性(differentiation)與可塑性(plasticity)的運用。目前研究指出3種細胞形式的內皮先驅細胞:CD34+CD31+內皮先驅細胞(cEPC)、骨髓系內皮先驅細胞(myeloid-derived EPCs, CFU-EC)與衍生內皮先驅細胞(outgrowth EPC, ECFC)均在動脈硬化或血管新生(angiogenesis)過程中扮演不同的角色。本研究首先發現平滑肌細胞(smooth muscle cells)與內皮細胞(endothelial cells)所組成之共同血管微環境系統(vascular niche)可藉由β2 Integrin與Notch-1訊息誘導cEPC的移動性(mobility)與分化潛能改變,呈現區域分化(compartmental differentiation)生成CFU-EC與ECFC;進一步,在肝癌共同培養系統中,CFU-EC會藉由分泌出單核細胞趨化蛋白(monocyte chemoattractant protein-1, MCP-1)直接誘發肝癌細胞微型核醣核酸21型(microRNA-21)之新生表現(biogenesis),導致肝癌細胞發生上皮-間質轉化(epithelial-mesenchymal transition),並增加肝癌細胞侵入性能力及惡性轉移之機率,顯示來自血液衍生出的內皮先驅細胞可經由不同細胞微環境間的分子交互作用,調節分化潛能及分布,參與動脈硬化及癌症轉移之病程。因此本研究不僅使研究團隊更加瞭解動脈硬化或腫瘤轉移的機制,同時也對於未來的心血管或腫瘤疾病提供新的治療與預防方向。
《文/圖:細胞及系統醫學研究所;資料來源:施佑宗;指導研究員:裘正健研究員》