NHRI Communications

研究發展
辨識抗嚴重急性呼吸道症候群-冠狀病毒棘蛋白之雞源性免疫單鏈變異區片段抗體
Chicken single-chain variable fragments against the SARS-CoV spike protein
 2002年11月,嚴重急性呼吸道症候群(Severe Acute Respiratory Syndrome, 簡稱 SARS)爆發於中國廣東一帶,並且迅速地漫延至其他國家。根據世界衛生組織從2002年11月至2003年7月的統計,全球總病例8,096人(含台灣地區346病例),並造成774人死亡,一度引起全球人類極度恐慌。其主要病因是由SARS冠狀病毒(SARS-CoV)所引發的巨噬細胞活化,導致過量產生與發炎反應有關的細胞激素如IL-1、IL-6、或IL-8。其後果可能引發「細胞激素風暴」(Cytokine Storm)的現象,進而造成嚴重地肺部病變,導致病患呼吸困難,甚至死亡。由於此病毒的高傳染率、致死率以及再發的不確定性,因此精確地診斷和發展有效的抗SARS冠狀病毒的抗體或疫苗,對於日後控制此病毒所造成的公共衛生威脅是有其必要性。筆者有幸參與那時由台北醫學大學楊沂淵老師所主導的抗SARS冠狀病毒抗體的發展,成功地開發出抗冠狀病毒棘蛋白的單鏈抗體,其結果也發表於國際知名期刊。以下是筆者簡述此抗體發展過程。
2002年11月,嚴重急性呼吸道症候群(Severe Acute Respiratory Syndrome, 簡稱 SARS)爆發於中國廣東一帶,並且迅速地漫延至其他國家。根據世界衛生組織從2002年11月至2003年7月的統計,全球總病例8,096人(含台灣地區346病例),並造成774人死亡,一度引起全球人類極度恐慌。其主要病因是由SARS冠狀病毒(SARS-CoV)所引發的巨噬細胞活化,導致過量產生與發炎反應有關的細胞激素如IL-1、IL-6、或IL-8。其後果可能引發「細胞激素風暴」(Cytokine Storm)的現象,進而造成嚴重地肺部病變,導致病患呼吸困難,甚至死亡。由於此病毒的高傳染率、致死率以及再發的不確定性,因此精確地診斷和發展有效的抗SARS冠狀病毒的抗體或疫苗,對於日後控制此病毒所造成的公共衛生威脅是有其必要性。筆者有幸參與那時由台北醫學大學楊沂淵老師所主導的抗SARS冠狀病毒抗體的發展,成功地開發出抗冠狀病毒棘蛋白的單鏈抗體,其結果也發表於國際知名期刊。以下是筆者簡述此抗體發展過程。嚴重急性呼吸道症候群是由一種新的冠狀病毒所引起的傳染性疾病。為了對付未來SARS再次爆發的可能性,有必要發展有效的診斷和治療藥劑。SARS-CoV已知有四個主要結構蛋白,分別為棘蛋白(spike; S)、膜蛋白(membrane; M)、套膜蛋白(envelope; E)和核蛋白 (nucleocapsid; N)。其中棘蛋白被發現在病毒感染宿主的機制上扮演著重要的角色,也是引起宿主產生中和性抗體的主要蛋白。有研究顯示當小鼠接受重組(recombinant)棘蛋白分子防疫注射後,可以保護牠們不被 SARS-CoV所感染。這些結果都表示重組棘蛋白會是一個用來研發疫苗和抗病毒藥物很好的標的抗原,對於用來製造具有識別棘蛋白特異性的單株抗體也是非常有用的。
使用傳統融合瘤(hybridoma)製造老鼠單株抗體的方法已行之多年且技術上也相當成熟穩定,不過,其過程繁複、容易受到污染且價格昂貴。而用來製造人類單株抗體以應用在診療上,現階段也有無法克服的困難,例如無法找到適當與人類B細胞融合的腫瘤細胞及其他目前無法確定之因素。為了克服以上所提的問題,以便快速且經濟地產生抗SARS-CoV的多株及單株的抗體,因此,我們首先純化各個不同片段的SARS-CoV之S蛋白來免疫雞隻,確定產生特異性的多株抗體後,再利用最近發展的噬菌體展出系統(phage display system)將所有表現之免疫球蛋白基因轉殖入特定的噬菌體載體中,以利篩選出特異性的鳥類抗 SARS-CoV單株抗體。相較之下,噬菌體展出系統的體外抗體選殖,以及隨後從重組抗體庫(combinatorial antibody libraries)中篩選分離出來的單株抗體(monoclonal antibodies)步驟,不論操作過程、安全性、時效性,以及花費考量等方面都優於融合瘤的技術。而且,噬菌體展出系統可以視應用的目的而有效地製造出各種大小不同的重組抗體(recombinant antibodies),包括含Fc 部分的完整的全抗體(whole antibody)、含與抗原結合的片段(antigen-binding fragment; Fab)抗體、只含輕鏈及重鏈之變異區組成的單鏈變異區片段(single-chain variable fragment; scFv)抗體,以及其他多種不同的變化組合。總而言之,運用雞隻來生產抗體是可行的且效率非常高。過去已有許多研究顯示,使用噬菌體展出系統來構建雞源性抗體庫可以生產出高親合性的(high-affinity)單鏈變異區抗體,並應用於基礎研究與臨床診斷上。
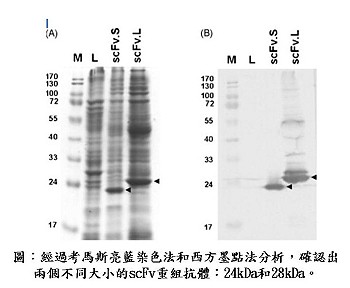
研究團隊進行之研究包括,於大腸桿菌細胞株(Escherichia coli cells)表現十種截短(truncated)棘蛋白基因片段,再將這些純化重組棘蛋白免疫注射於雞隻,然後建構多個分別含有短連接子和長連接子(linker)的單鏈變異片段(scFv)抗體基因庫。經過四次的仔細篩選(panning)後,任意選擇的轉殖基因株所表現的單鏈抗體分子,經由考馬斯亮藍染色法(Coomassie blue staining)篩選和西方墨點法(western blot)分析確認後,再與雞的免疫球蛋白種系(germline)基因做核酸序列(nucleotide sequences)的比對,證實它們都是免疫球蛋白基因。隨後我們更進一步發現所有篩選的轉殖基因株中,有兩個單鏈抗體對已被SARS-CoV 感染的Vero細胞有顯著地反應,而且這兩個單鏈抗體分別辨認位於棘蛋白上750至1000以及456 至 650的氨基酸(amino acid)區域的抗原決定位(antigenic epitopes)。我們認為利用噬菌體展出系統篩選出來的這些特異性的scFv單株抗體以及它們所辨認的棘蛋白抗原決定位,對於日後的疫苗與檢驗試劑的研製是非常有幫助的。
筆者藉由這次SARS-CoV無預警的襲擊全世界而建立與台北醫學大學的合作,合作過程中,我們看到了一種新病毒對於人類的巨大衝擊,包括生活上、經濟上、道德上以及資源的分配上,其中,當然不乏感人又感傷的故事,人性的脆弱在這次的SARS-CoV風暴表露無遺。要感謝的人真的太多,在此特別要感謝北醫大前任許重義校長,現任邱文達校長(當時為萬芳醫院院長)全力提供空間、設備及各種資源,北醫大楊沂淵副教授,台大醫學院江伯倫教授,雙和醫院神經內科胡朝榮主任(當時為仁愛醫院分子檢驗室主任),實際處理SARS-CoV感染的檢體與操作PCR實驗的三位萬芳檢驗科同仁,余芳蘭、洪經勝與蘇家慧醫檢師,以及檢驗科謝銘松主任。目前,我們也更緊密地與北醫大合作,利用這個成熟的噬菌體展出技術來製造具有特異性的抗體,來辨識與腫瘤相關的抗原(tumor-associated antigens)或腫瘤特異性的抗原(tumor-specific antigens),希望未來能對於癌症的診斷甚至於治療上有所貢獻。
《文/圖:癌症研究所施能耀博士》