NHRI Communications

會議報導
演講紀要:探討Prostacyclin在內皮細胞裡的保護機制
Lecture Summary: The Protective Mechanism of Prostacyclin in Endothelial Cells
 本院於10月31日至11月2日舉行血管生物學研討會(2008 NHRI Vascular Biology Conference),地點為本院會議中心之國際演講廳,參加人數逾兩百人,研討會主題如下:
本院於10月31日至11月2日舉行血管生物學研討會(2008 NHRI Vascular Biology Conference),地點為本院會議中心之國際演講廳,參加人數逾兩百人,研討會主題如下:Session I - Angiogenesis & Vasculogenesis(血管新生與脈管生成)
Session II - EC & Smooth Cell(內皮細胞與平滑肌細胞)
Session III - Neural Regulation(神經調控)
Session IV - Vascular Diseases; Vascular Injury & Inflammation(血管疾病:血管損傷與發炎)
Session V - Septic Shock(敗血性休克)
Session VI - Gene Transcripition & Signaling Transduction(基因轉錄與訊息傳導)
Session VII - Blood Cell & Vessel Wall Interaction(血球與血管壁相互作用)
其中細胞及系統醫學研究所劉俊揚助研究員以「探討Prostacyclin在內皮細胞裡的保護機制」發表專題演講,謹摘要其精采內容於次。
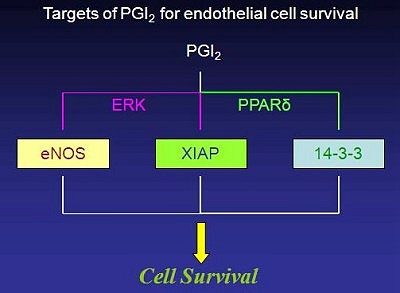
本研究為探討Prostacyclin(PGI2)在保護血管內皮細胞(endothelial cells)存活所扮演之角色,基於劉俊揚博士對於細胞凋零(apoptosis)具相當之興趣,進而開始研究可能的相關機制。劉博士的演講針對三個部份進行介紹。第一部分是發現PGI2可能經由活化PPARδ來誘導內皮細胞裡14-3-3之蛋白質表達,細胞內14-3-3之增加會與Bad結合並減少Bad轉移到粒線體上,此反應進一步減緩經由粒線體所引起之細胞凋亡。第二部分是PGI2透過Ras依賴性的訊息傳遞路徑增加endothelial nitric oxide synthase(eNOS)的蛋白質轉錄調控(transcriptional regulation)。第三部分是介紹PGI2透過Ras依賴性的ERK活化可能透過磷酸化作用機制(phosphorylation mechanism),保護X-linked inhibitor of apoptosis蛋白質(XIAP)被蛋白酶體(proteasome)分解。這三個訊息傳遞路徑可以一起作用保護血管內皮細胞,防止細胞凋亡。
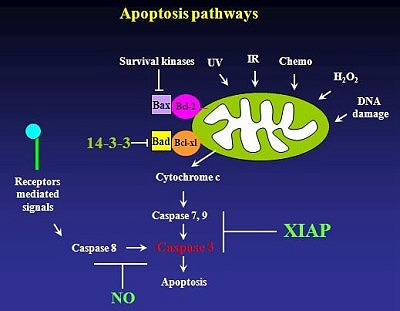
在若干多環氧化酵素(cyclooxygenase, COX)下游的前列腺素(prostaglandins)產物中,最熟知主要跟保護細胞有關的是PGI2跟PGE2。研究團隊在這幾年陸陸續續找到幾個與細胞存活有關PGI2可能之目標因子,第一是與PGI2可能有crosstalk關係的nitric oxide生成酵素。此外在探討PGI2之保護細胞的效果時所進行caspases跟Bcl-2 family蛋白質的一些分析試驗,發現PGI2有保護caspase活化的作用。在進一步研究其上下游相關聯之機轉作用中,發現其中比較有趣的是inhibitor of apoptosis protein (IAP) family,尤其是XIAP蛋白質。由於在探討Bcl-2 family之實驗中,其蛋白質本身的表現並沒有受到PGI2的改變,而有趣的現象是PGI2會減少在誘導細胞凋亡時Bad轉移到粒線體。由於14-3-3調控Bad轉移到粒線體之機轉主要是透過與Bad結合並控制其在細胞漿(cytosol)之中,因此探討PGI2對14-3-3之調控也就成為實驗室研究的方向之一。
由於利用liposome於內皮細胞之轉染效率不高,然而腺病毒(Adenovirus)載體於內皮細胞在基因轉染(transfection)效率上卻十分良好,因此研究團隊利用腺病毒載體系統對內皮細胞進行轉染實驗。首先將Ad-COPI(COX-PGIS)轉染至HUVEC細胞時,發現利用H 2O 2誘導的內皮細胞細胞凋亡會被Ad-COPI的過度表現(over-expression)所減緩。除了使用腺病毒基因傳遞方式外,穩定性PGI2類似物─carbaprostacyclin, cPGI2,亦有相同的保護效果。然而處理PGE2之結果顯示並無類似之保護,因此往後的研究實驗便主要集中在PGI2上。
一般來說,PGI2是透過在細胞膜上的一個IP受體(receptor),透過small G蛋白質增加cyclic AMP然後活化PKA訊息傳遞路徑。此外在後來的研究中被發現PGI2有可能是PPARδ的配體(ligand)並活化PPARδ的訊息傳遞路徑。研究團隊利用PKA的抑制物阻擋其活化,發現對PGI2保護H2O2誘導性的細胞凋亡並無顯著影響,因此排除PKA參與之可能性。第二步利用Ad-PPARδ過度表現PPARδ時,發現Ad-COPI與Ad-PPARδ會協力減少H2O2引起之細胞凋亡。此外利用PPARδ的selective ligand, L-165041所得到之結果與Ad-PPARδ之保護效果相似,因此證實PPARδ可能是一個主要的調控機轉。
由於先前的實驗結果發現Bad蛋白質的轉移有所改變,所以進一步著眼於14-3-3蛋白質之上。14-3-3在所有哺乳類動物裡面,有7個同型體(isoforms)。研究結果發現PGI2或L-165041活化PPARδ之後,其中有幾個同型體會增加,但最主要的是epsilon (ε)同型體。而使用siRNA將PPARδ knock down後,上述的增加情況會被減緩,進一步證實PPARδ對14-3-3調控之重要性。由於ε同型體在所有哺乳類動物裡之相似度最高,且在這項研究裡為誘導增加效果最顯著之isoform,因此便利用其做為爾後研究之實驗model。為探討調節14-3-3的機制,首先,研究團隊複製出人類5’端約1.6 kb的14-3-3ε啟動子區(promoter region),進一步在DNA定序分析過程中,發現大約在-1.3 Kb的位置可能有PPARδ之結合位置(binding site)。接著利用製造各種不同基因缺失(deletion)的14-3-3ε啟動子區,在刪除掉PPARδ可能的結合位置之後,發現PPARδ與COPI過度表現後所增加的啟動子活化效果便即消失,因此證實此區域對PPARδ結合的反應元件(response element)之重要性。此外亦利用染色質免疫沉澱(Chromatin immunoprecipitation, ChIP)的方式,將PPARδ的抗體免疫沉澱後用PCR定量,發現PGI2 跟L-165041會增加與PPARδ與反應元件區域之結合。進一步證明這個結合作用對於14-3-3基因調控是必要的。
研究的第二部分想了解PGI2與eNOS間是否有crosstalk之現象。使用轉染的方式來測量eNOS的磷酸化作用,並沒有發現明顯的改變,但處理PGI2明顯增加eNOS蛋白質之表達。此外eNOS的啟動子活性亦為PGI2所誘導增加。
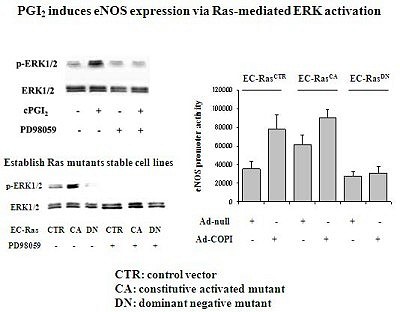
由於PGI2調節eNOS之詳細訊息機制並未清楚。劉博士的研究團隊利用PI3K、MEK和PKA抑制物進行實驗,結果發現Ad-COPI過度表現所產生的PGI2會增加eNOS的啟動子活性,而MEK之專一性抑制物─PD98059─則會阻止eNOS為PGI2所誘導。相反的,PI3K或是PKA的抑制物就沒有明顯抑制效果,因此推測MEK-ERK是一個調節eNOS主要的訊息傳遞路徑。研究中亦發現PGI2可誘導內皮細胞ERK磷酸化,但這個機制是經由IP receptors還是經由PPARδ,目前還是未知。此外為了進一步證明MEK-ERK對於上述現象的重要性,實驗室建立3種Ras細胞株,控制組EC-RasCTR、實驗組EC-RasCA(會固定活化Ras-Raf-MEK-ERK的細胞株)及EC-RasDN(DN: dominant negative mutant)。研究結果發現在EC-RasDN的細胞株中,過度表現Ad-COPI所誘導的eNOS啟動子活性相形減緩,因此證實Ras所扮演之重要角色。
第三部份在對幾個IAPs的蛋白質表現研究中,發現H2O2誘導的細胞凋亡會選擇性地減少XIAP和Survivin。處理PGI2會劑量依賴性(dose-dependence)恢復 XIAP之表現,但對survivin則無影響。由於已知IAPs主要功能是直接與caspase相互作用並抑制caspase的活性,並進一步增加caspase本身的蛋白質泛素化作用(ubiquitination)與降解作用(degradation),為了證實PGI2選擇性地保護XIAP是否透過此proteasome之機制,研究團隊發現加入proteasome抑制劑後有效地恢復H2O2處理所減少之XIAP表現,接下來對XIAP ubiquitination的研究,也結果發現cPGI2可有效地抑制H2O2引起之XIAP ubiquitination,並發現MEK-ERK的抑制物會有效地阻擋PGI2恢復XIAP及減少ubiquitination之功能。此外利用所建立的穩定性細胞株研究發現,PGI2所減少的XIAP degradation在EC-RasDN細胞裡並無明顯之效果。這些研究結果證實MAPK-ERK的重要性。
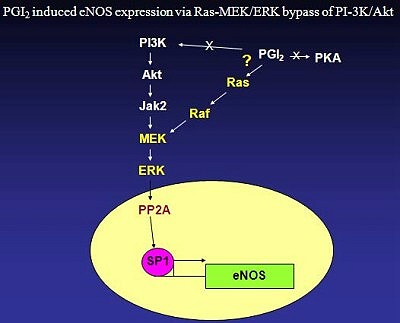
總結整體研究結果,劉博士的研究團隊提供了幾個證據:
一、PGI2活化PPARδ表達14-3-3ε;
二、PGI2誘導eNOS的表現,產生nitric oxide;
三、PGI2經由Ras所調節的ERK訊息傳遞路徑,來防止XIAP發生降解作用。
這幾個機制協力共同保護內皮細胞免受外來刺激所引起之傷害。
《文圖:細胞及系統醫學研究所劉俊揚助研究員演講;編輯中心劉盈秀整理》