NHRI Communications

會議報導
國家衛生研究院實證醫學學術研究工作坊系列報導(二)- 研究規劃
A Serial Report for NHRI Evidence-based Medicine (EBM) Workshop - Planning research
 對於研究規劃,Dr. Summerskill提出4點注意事項:(1)規劃研究時同時思考論文發表形式;(2)撰寫論文及投稿時要參照期刊發表指引;(3)瞭解期刊著重的內容與要點、研究發表的趨勢、文稿被同儕審閱的重點;(4)注意目標發表期刊的品質、編輯者、研究倫理規範、作者排序及審查委員組成。
對於研究規劃,Dr. Summerskill提出4點注意事項:(1)規劃研究時同時思考論文發表形式;(2)撰寫論文及投稿時要參照期刊發表指引;(3)瞭解期刊著重的內容與要點、研究發表的趨勢、文稿被同儕審閱的重點;(4)注意目標發表期刊的品質、編輯者、研究倫理規範、作者排序及審查委員組成。Dr. Summerskill提醒研究者在規劃臨床研究時,可以參考ICMJE指引(International Committee of Medical Journal Editors,ICMJE)進行規劃,還可考量臨床試驗執行者(trialist)、統計學家、機構裡審查委員的意見。他表示,研究設計的好壞會從各個角度影響研究的表現,包括研究論文的發表,而設計良好的臨床試驗會讓試驗流程的組織管理、執行、資料分析、論文撰寫與發表更順利。
他還指出,研究成果可成功發表的關鍵因素就是在對的時間用對的方法解答了對的問題,這裡所謂成功的研究發表必須具有臨床上的重要性,也要具有新穎性。而有正向的結果及很小的拒絕假設機率(p-value)並不一定就代表是成功的研究成果,還要考慮研究的發現是否具有可信度(reliable)?是否具有說服力(conclusive)?是否能提供臨床運用更多的訊息?此外,成功的研究發表必須以正確及清楚的表達方式描述研究架構及成果。他表示,The Lancet有一個文字編輯小組,可以協助投稿者進行論文文字的改寫,而精準的文字描述能更清楚地傳達研究試驗的想法。
Dr. Summerskill說明ICMJE是由許多國際知名期刊的編輯共同組成,並集結眾多編輯的意見編撰成ICMJE生物醫學期刊指引(Uniform Requirements for Manuscript Submitted to Biomedical Journals: Writing and Editing for Biomedical Publication),最新版甫於2008年10月出版。ICMJE的期刊編輯成員來自位於挪威、丹麥、荷蘭、克羅埃西亞(Croatia)、紐西蘭及澳洲等國的Annuals、BMJ、CMAJ、JAMA、NEJM、Lancet等期刊,以及美國國家醫學圖書館(U.S. National Library of Medicine)。
研究成果發表的策略
Dr. Summerskill提醒,研究成果呈現方式要在研究規劃之初就預先設想,而非等研究完成時才開始進行組織,這個作法還牽涉發表文章所需經費的規劃。投稿不同期刊有不同的費用標準,有些期刊對彩色頁的印刷還要求額外的費用。
有關臨床研究流程(protocol)的規劃部份,有些研究者會預先寫信給目標投稿期刊的編輯,預先知會將進行的臨床試驗主題及執行流程,引起期刊編輯的注意。以The Lancet的作法,編輯委員如果認為該臨床試驗的設計妥當,值得預先提供給臨床工作者,會將訊息公告在The Lancet的網站上。
研究設計的描述必須包括一些期刊所要求及注重的項目,例如研究試驗是否具有隨機性(randomization),研究樣本數是否具有可信度。研究執行過程的描述則必須聚焦在可支持發表內容的數據,不要提供不相干或是會分散焦點的資訊。
此外,發表臨床研究時,有些國家(例如日本)會要求研究之前要獲得該國或該地區的研究許可證明才能夠進行試驗或發表,通常專業期刊也會依照各國的作法在審查稿件時要求研究者要提供相關證明文件,才能夠進行審核或接受刊登。
臨床試驗研究設計注意事項
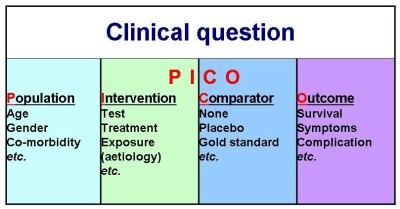
Dr. Summerskill表示,在研究規劃與設計時,要清楚定義臨床研究問題,這些研究問題是要有意義的,要專注在某一項議題上,要是可以被回答的。在定義臨床問題上有一個名為PICO的因素架構可以作為遵循的依據,這個架構建議以研究的Population(目標族群)、Intervention(介入方式)、Comparator(對照組處理)及Outcome(預期結果)4個思考方向進行規劃。
目標族群要考慮的因子包括年齡、性別、合併症(co-morbidity)等;介入試驗的方式要明確說明所針對的病因(aetiology)、試驗方式(test)、治療方法(treatment)等;對照組處理的部份可能有不另加處理、以安慰劑處理(placebo)、以公認標準模式處理(gold standard)等;預期結果部份可以存活率、症狀、併發症狀等表現模式呈現。
臨床試驗研究設計上要特別著墨的部份包括:(1)設計試驗來回答所欲解答的問題;(2)明確的試驗目標族群;(3)具代表性的樣本規模;(4)正確的事前規劃分析(pre-specified analysis);(5)遵循期刊所規定的研究成果發表指引項目;(6)將試驗流程請同儕或合作者進行審閱,以使試驗結果更具應用價值。
設定「目標試驗族群」時,要將納入及排除的條件進行明確的定義,具體規劃招募試驗對象的方法,對於現有共病現象進行調查瞭解,儘可能進行多區域多重族群之整合性試驗。以The Lancet所重視的焦點為例,主題焦點比較狹窄的研究被接受的機率較低,此期刊希望所刊登的研究試驗盡可能是針對普世共通的疾病,且試驗結果是具有普世皆可適用的價值。所謂共通疾病指的是例如腎臟疾病、吸菸問題、糖尿病、肥胖等不分區域種族皆可能發生的疾病。
決定「試驗樣本規模」時,必須要考量是否具有可信度,要儘可能考慮周全,要儘可能降低第二型誤差(type II error)的發生機率β值。「試驗的執行時間及後續追蹤期限」要長到足以累積適當的事件發生率(event rate),也必須短到足以維持具有可信度的追蹤樣本數。在進行「事前規劃分析」時,要針對試驗預計結果設定可信且具有意義的試驗終止療效(endpoints),使最終療效的試驗結果可以增加病患治療上的參考價值。最終療效還要盡可能具有延伸性的應用價值,可運用在其他試驗條件(settings)下,並且是對病患、臨床醫療人員及政策制訂者都具有切身相關性及效用。
「分析方法」的規劃必須在規劃臨床試驗之初就加以選定,選擇的方法必須從臨床試驗的設計邏輯進行考量。近年來在臨床試驗上提倡採用「治療意向(intention to treat,ITT)」分析法,將病人遵從醫囑的程度納入考量,分析試驗過程中各種處理方式對分析結果的影響。統計方法的選擇上可考慮使用多重比較法(multiple comparisons)及事後分析法(post hoc analysis),而進行子群體分析時,尤其有多種療效(multiple outcomes)比較分析時,需注意其第一型誤差(type I error)發生的機率通常會依據所用以比較療效的多寡而有不同。假設α值設為0.05,只比較1種療效時,發生第一型誤差的機率就是0.05;如果比較療效多至20項種時,發生第一型誤差的機率就是0.64。
期刊論文發表指引
Dr. Summerskill指出,研究人員可以從各種期刊的網站上獲得研究發表的檢核標準,這些標準是研究規劃時很重要的參考資料。他列舉了幾種針對不同研究設計的論文撰寫指引: CONSORT(Consolidated Standards of Reporting Trials)研究檢核準則是針對隨機對照臨床試驗(RCT)的報告格式;STROBE(The Strengthening the Reporting of Observational Studies in Epidemiology)是觀察型研究的檢核準則;QUOROM(The Quality of Reporting of Meta-analyses)是RCT研究的統合分析檢核準則;STARD(Standards for Reporting Studies of Diagnostic Accuracy)是診斷性研究的報告準則。
論文撰寫參考資訊
如何開始撰寫研究論文呢?Dr. Summerskill提供他個人的親身體驗。他表示,年輕研究者在撰寫論文之前,可以先從請教研究團隊裡資深研究人員獲取相關的經驗與建議。在整個研究歷程中,多花一些時間在研究規劃上,可以讓後續研究執行及論文撰寫更容易,更快進入狀況。他還建議,撰寫論文時最好只專注在同一篇論文的內容,當心中產生該研究以外的想法時,宜暫時停止撰寫的工作,以免脫離該論文的焦點。The Lancet給作者的相關建議可由其網頁(http://www.thelancet.com/authors/lancet/authorinfo)進行瀏覽。
《文/圖:The Lancet執行編輯Dr. Summerskill演講;編輯中心吳萃慧整理;審校:群體健康科學研究所衛生政策研發中心郭耿南主任》