NHRI Communications

會議報導
2009人體試驗研究人員講習班(一)
Clinical Investigator Training Class 2009 (Part I)
 為提升研究人員對生物醫學研究倫理及人體試驗相關法規之瞭解,避免因為不諳法令,發生違反研究倫理情事,本院醫學研究倫理委員會在2009年7月2日於本院竹南院區與財團法人醫學研究倫理基金會共同舉辦一場「人體試驗研究人員講習班」,邀請三軍總醫院汪志雄副院長、台北榮民總醫院暨聯合人體試驗委員會郭英調醫師、博觀法律事務所林志六醫師暨律師、及財團法人彰化基督教醫院陳書毓督導長進行課程講授,並於會後進行認證考試。
為提升研究人員對生物醫學研究倫理及人體試驗相關法規之瞭解,避免因為不諳法令,發生違反研究倫理情事,本院醫學研究倫理委員會在2009年7月2日於本院竹南院區與財團法人醫學研究倫理基金會共同舉辦一場「人體試驗研究人員講習班」,邀請三軍總醫院汪志雄副院長、台北榮民總醫院暨聯合人體試驗委員會郭英調醫師、博觀法律事務所林志六醫師暨律師、及財團法人彰化基督教醫院陳書毓督導長進行課程講授,並於會後進行認證考試。此次講習班課程內容包括:「研究倫理的發展與國際現況」,由汪志雄副院長講授;「人體試驗之法律責任及相關法令簡介」,由郭英調醫師講授;「2008年版赫爾辛基宣言介紹」,由林志六醫師講授;「知情同意的過程與受試者同意書」、「研究人員對人體試驗委員會應有的認識」與「藥品優良臨床試驗準則(GCP)」,由陳書毓督導長講授。
一、研究倫理的發展與國際現況
汪志雄副院長首先介紹國際上研究倫理規範發展的演進歷史,由「紐倫堡法案(Nuremberg Code)」、「赫爾辛基宣言(Declaration of Helsinki)」、美國的「National Research Act」及「Belmont Report」的逐步簽署實施、到FDA發展出知情同意(informed consent)的相關步驟及規定、乃至要求機構成立人體試驗審查委員會(Institutional Review Board,IRB)進行研究倫理審查,監督機制已逐步建立。
汪副院長接著說明IRB肩負的使命與責任、應審查範圍、及執行上的爭議。IRB與政府監督管理單位(衛生署、國科會等)、贊助者(政府或私人經費提供單位)對受試者的保護都負有同等重要的責任。IRB從研究開始之前到結束的每個階段,都要肩負倫理審查及稽核的責任;政府相關管理單位有責任定期對機構IRB進行訪查,評估機構IRB之運作與審查是否確實執行。近年來,國內部分醫療與研究機構還主動透過亞太地區倫理審查論壇(FERCAP)之訪查與認證,以彰顯機構人體試驗運作具有國際水準。
汪副院長最後勉勵計畫主持人及相關研究人員要秉持試驗倫理的原則:尊重、善益及正義進行研究,確實遵守「IRB審查」與「告知同意」之受試者保護機制。IRB對研究倫理審查與稽核的保護關卡,可以確保醫療單位及研究者預先做好受試者保護,防止無意的違法行為與潛在的糾紛。
二、人體試驗之法律責任及相關法令
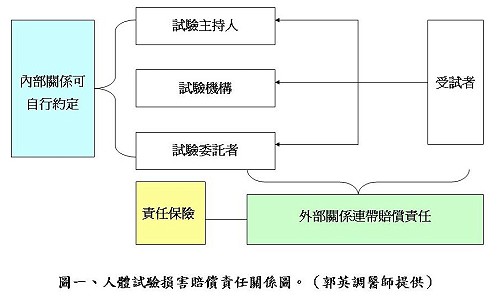
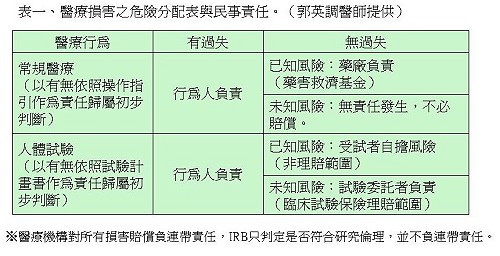
郭英調醫師從民法、刑法、醫療法、醫師法、健保法、藥品優良臨床試驗準則、電腦處理個人資料保護法等人體試驗相關法律與基準的角度,說明醫院、醫師與研究人員各種醫療行為與臨床研究流程涉及的研究倫理規範面向,以及未遵守相關規範或有過失的情況下可能面臨的責任(圖一)與罰則(例如民事賠償責任,表一)。
郭醫師還針對我國目前有關人體試驗的相關法律基準(guidelines,共31種)作簡要說明。其中主要的基準包括:醫療機構人體試驗委員會組織及作業基準、人體研究倫理政策指引、研究用人體檢體採集與使用注意事項。其他指引則分別是針對特定人體試驗、特殊藥物試驗、特殊研究族群、特殊試驗操作、研究倫理審查流程、受試者知情同意書、及試驗主持人的資格條件所進行的規範。
三、2008年版赫爾辛基宣言介紹
林志六醫師針對2008年新修正的赫爾辛基宣言進行逐條解釋,並說明台灣目前相關法律對應的法規與基準,也提出相對應的法規中有哪些值得再商榷,以更符合我國民情與法律制度。
有關受試者對知情同意書是否確實瞭解,林醫師也說明國外常用的相關評量回饋工具「Informed Consent Evaluation Feedback Tool(ICE FT)」,此工具中敘明在對受試者進行研究及同意書內容說明後,可用10個問題評估民眾的瞭解程度:(1)研究的目的、(2)研究的可能獲益、(3)研究的可能風險、(4)受試者有無其他治療選擇、(5)試驗的費用是否由研究贊助人支應、(6)是否自願參加此試驗、(7)相關政府單位及贊助人是否有權檢閱此試驗相關的個人資料、(8)受試者是否有義務全程參與、(9)受試者的試驗方式是否由研究人員選擇、(10)受試者是否可能無法由試驗中獲得好處、(11)其他提問。
《文/圖:人體試驗研究人員講習班;編輯中心吳萃慧整理;審校:本院群體健康科學研究所衛生政策研究組許志成副研究員》