NHRI Communications

會議報導
疫苗製程細胞培養生物反應器操作之經驗分享(二)
NHRI researcher shares experience on cell culture bioreactor operation(Part 2 of 2)
 生物反應器的選擇
生物反應器的選擇本院在量產疫苗抗原(H5N1)過程中,以狗腎细胞株(MDCK)來繁殖病毒,以2種培養技術進行。低細胞密度培養仍然採用傳統的1700 cm2 轉瓶(roller bottle)培養技術,雖然產能較小(60公升),但是製程穩定;高細胞密度量產就必須倚賴生物反應器,疫苗中心生物反應器規模由2.2公升、7.5公升、30公升至150公升的微載體細胞培養生物反應器(microcarrier cell culture bioreactor)。cGMP核心設施內的150公升生物反應器正在進行量產測試,雖然規模比起商業級疫苗工廠用的要小很多,但以H5N1為例,這個規模的生物反應器所製造出的疫苗產能可達到每批次4~5萬劑疫苗。
以MCDK細胞生產疫苗時,所用的生物反應器基質很重要,要盡量避免用具有動物性基質(例如膠原蛋白)的生物反應器。過去2年,疫苗中心所用的製程技術主要是從台灣疾病管制局所移轉過來的含血清培養技術為主,這個技術所用的血清品質佳,能讓細胞快速成長,但價格也大約是一般的2倍。血清是一個成本高、每批次成分不均的原物料,因此未來不會是技術發展的趨勢,正因此,疫苗中心也正努力研發無血清的培養技術,經一番篩選後,目前使用由一家台灣本土廠商供應的Plus-MDCK培養基,病毒的產能與含血清的DMEM+5%FBS培養基比較起來,可以得到多10%以上的HA產量,表現也很穩定。
在決定使用生物反應器來培養細胞,生物反應器的選擇也相當重要,尤其是在工業界的廠商,可以隨時由有關細胞量產技術的專業期刊(例如BioPharm或BioProcessing)中瞭解最新的生物反應器或是下游生產技術的發展趨勢。BioPharm期刊在1996年刊出的一篇文章「Julia Cino and Standley Frey. 20 Tips for Purchasing Bioreactors. BioPharm, Sep. 1996(按此免費下載)」第54頁列出挑選生物反應器的20個訣竅,其中第4、13、14、16、17及19項特別值得注意。
§4. Beware of unsanitary threads and fittings
- 在選擇大型生物反應器時要特別注意一些清潔上的死角,例如反應器上的各種閥體,以前所使用的球閥(ball valve)或針狀閥(needle valve)已經不符合cGMP的要求,必須選用隔膜閥(diaphragm valve)的種類,以方便清理。
§13. Make sure you get all the parts and pieces you need
- 有些反應器製造商會一直推出新的產品機種,所以並不一定會經常有某一種機種的零件庫存備用,例如反應器上的閥體,在購買反應器時,最好能備存足夠的閥體或零件以供更換,以免無備品更換影響生產。
§14. Know what instruments are included in the manufacturer's quote
- 預先規劃所需的反應器功能與相關配件,與供應商討論並詳閱其商品目錄及估價單相關說明,在購買時要先確認這些配件是否包括在主體的價格,還是要分開購買。
§16. Ask the manufacturer about its FDA validation package
- 因為生醫產品及疫苗等生產一定得符合cGMP規範,而這些規範主要參考美國食品藥物管理局(FDA)的規定,因此要確認所選用的反應器是否符合FDA確效(validation)的相關要求。
§17. Know who will service your system and where
- 與供應商、製造商、工程人員或是業務代表維持良好關係,可以保持資訊流通無礙以及更好的服務品質。
§19. Ask about start-up assistance and service agreements
- 一般研究人員對於開始使用大型反應器都無法馬上上手,可以在合約上要求供應廠商提供初期運轉時的協助服務,以使反應器能在初步試運轉就能穩定起步。
此外,反應器有許多形式,其中對反應器中細胞與培養基混合狀況影響最大的是攪拌的方式。有些反應器是採用攪拌槳(impeller)的形式,有些是氣升式(air-lift或cell-lift)的攪拌法,依細胞株特性選擇適當種類的攪拌方式是很重要的,也可選擇可更換攪拌形式的反應器,擴充反應器的用途。若是採用impeller式的反應器,要考慮到所選用的impeller對細胞造成的剪力(shear force)效應,因為有些細胞的生長很容易受到剪力影響,因此也要對所選用的細胞株特性有所瞭解。
生物反應器設備確效(equipment validation)
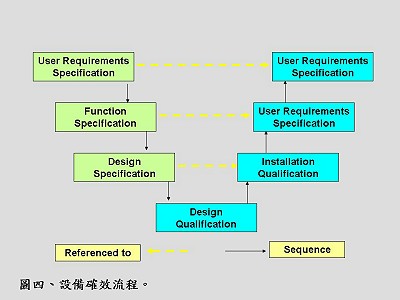 在使用生物反應器進行生產之前,要先對設備進行一系列的確效工作,相關流程如(圖四),加上未來運作時的標準流程(SOP),將整套流程建立成一個確效組合(validation package)。如果進行的是cGMP產品的生產,建議購買一套廠商所建立的確效文件,約設備成本的10-15%,從確效文件中學習廠商如何進行各種確效計劃書。
在使用生物反應器進行生產之前,要先對設備進行一系列的確效工作,相關流程如(圖四),加上未來運作時的標準流程(SOP),將整套流程建立成一個確效組合(validation package)。如果進行的是cGMP產品的生產,建議購買一套廠商所建立的確效文件,約設備成本的10-15%,從確效文件中學習廠商如何進行各種確效計劃書。開始規劃時,首先與供應商討論擬出使用者需求規格(user requirements specification)、設備的設計規格(design specification)、所需的設備功能規格(function specification),然後採購出符合規格的設備。設備不一定需要訂作客製化者,只需與供應商充分討論,選擇最能符合所需者即可。如果是客製化的設備,建議最好進行「廠驗測試(factory acceptance test,FAT)」及「現場驗測試(site acceptance test)」報告。取得設備後,一定要進行安裝驗證(installation qualification,IQ)、操作驗證(operational qualification)及表現驗證(performance qualification),這些程序都要在設計時考慮進去。有關確效的程序可參考相關網站(http://www.validation-online.net/)。
安裝驗證(IQ):主要是針對設備外部進行驗證,包括配件完整性、外觀(序號、型號等)、電壓、電子系統、警報系統、安裝位置、軟體系統、校正資料、周圍的配套條件、應提供的文件資料(例如系統維護資料)等。
操作驗證(OQ):針對所有迴路安裝(loop installation)狀況、整合迴路、操作功能狀況、警報及安全性系統、介面(interface)系統、系統連鎖(interlock)及可允許(permissive)狀況、資料庫及資料儲存完整性、報表輸出及事件紀錄系統、停電後回復狀況、電子及磁場干擾情形及相容性等之測試,各項功能必須符合美國聯邦規章法典第21卷第11部(21 CFR Part 11)的要求。
表現驗證(PQ):是設備確效的最後一項驗證,這部分是驗證生產流程模擬狀況的表現,確保系統及文件紀錄都足以確保之後運轉順利。這部分的驗證必須選擇適當的參數與測試時間間隔,明確定義「表現的標準(performance criteria)」、測試的程序,並規劃系統未達標準時的改正措施。
其他經驗分享
§污染處理
- 在從實驗室製程進入生產製程的初期,因為對生物反應器的操作比較生疏,又常要面對一次要運作幾個反應器的狀況,遭遇污染問題(contamination,非目標微生物的污染)是難免會發生的,因此要能夠系統化地分析污染的情況。分析時首先要瞭解這些污染原微生物的特性,是由空氣來的或是由水源來的,從根本找出導致的原因。
§清潔方式確效
- 生物反應器的清潔工作是確保反應器處於無菌及乾淨狀態,而清潔度確效通常會使用總有機碳法(Total organic carbon,TOC)或是導電度法(conductivity)來驗證。
§殺菌(Sterilization)
- 對反應器、各種容器、管路、原始材料(raw material)、人員無菌操作(aseptic handling)等程序都需進行系統化確認各步驟確實做到及驗證,尤其以管路配置的滅菌最重要,即使是依據SOP操作,也要經常性地檢驗。
§保養維護
- 儲備足夠的零件備品,定期進行保養維護,時間可設定3個月或6個月一次,視製程而定。
在使用生物反應器系統之前,要先詳閱設備手冊及管路儀表分佈圖(piping and instrumentation diagram,P&ID),確認所有閥的動線與開關機制,充分運用確效文件裡的資訊,做好各項處理的準備工作。
《文/圖四:胡勇誌博士後研究員演講資料;編輯中心吳萃慧整理;審校:胡勇誌博士》