NHRI Communications

研究發展
內質網壓力誘發鼻咽癌細胞中EB病毒致癌蛋白質LMP1的表現
NRHI researchers discover endoplasmic reticulum stress induces Epstein-Barr virus oncoprotein LMP1 in nasopharyngeal carcinoma cells
 在一項由本院感染症研究組張堯助研究員主導、成大醫院耳鼻喉科和病理科協助、並由國科會和本院計畫贊助的研究中,發現鼻咽癌細胞的內質網壓力(endoplasmic reticulum stress)會誘發EB病毒表現一種致癌蛋白質LMP1,顯示細胞的內質網壓力促進腫瘤病毒致癌基因的表現,可能是造成病毒相關癌症生成或惡化的機制之一。此研究成果已於去年發表在國際期刊Cancer Research 2009;69(10):4461-4467。
在一項由本院感染症研究組張堯助研究員主導、成大醫院耳鼻喉科和病理科協助、並由國科會和本院計畫贊助的研究中,發現鼻咽癌細胞的內質網壓力(endoplasmic reticulum stress)會誘發EB病毒表現一種致癌蛋白質LMP1,顯示細胞的內質網壓力促進腫瘤病毒致癌基因的表現,可能是造成病毒相關癌症生成或惡化的機制之一。此研究成果已於去年發表在國際期刊Cancer Research 2009;69(10):4461-4467。當細胞的內質網負荷超載或其功能受到干擾,例如凝集大量折疊錯誤的蛋白質或鈣離子通透失衡,會產生所謂的內質網壓力。細胞為因應此壓力而改變許多訊息傳遞和基因表現的現象,即稱為未折疊蛋白質反應(unfolded protein response, UPR)。與UPR相關的蛋白質對細胞的影響分成兩大方向:一為紓解內質網壓力,幫助細胞復原和存活;另一相反方向是當壓力過度而無法紓解時,則會促進受損細胞的死亡。腫瘤組織內部往往缺乏氧氣和養分,導致細胞內蛋白質合成時發生折疊錯誤,因而經常產生內質網壓力。在此嚴苛環境的持續篩選之下,腫瘤細胞發展出藉由表現出有利於細胞存活的UPR蛋白質來自我保護,抵抗壓力。
目前已證實多種UPR蛋白質會幫助腫瘤細胞在缺氧環境或化療藥物處理下的存活。這些UPR蛋白質可以在許多惡性腫瘤檢體中被偵測到,並且種類與含量跟其惡性程度、腫瘤轉移和抗藥性有關,因此可用於臨床檢測與治療上。目前此臨床應用分為兩種策略,一是阻斷那些能幫助癌細胞存活的UPR,另一種策略則是引發過度的內質網壓力讓癌細胞無法承受而凋亡。
過去探討內質網壓力如何參與病毒相關癌症的研究,大致上均認為腫瘤病毒會引發宿主細胞產生內質網壓力而促進細胞癌化。舉例來說,本院感染症研究組蘇益仁特聘研究員與成功大學的研究團隊發現突變的B型肝炎病毒表面抗原累積在內質網中會誘發內質網壓力,增加氧化性DNA損傷及基因體的不穩定性,因而促進肝癌的發展。其他腫瘤病毒如C型肝炎病毒和人類嗜T淋巴球病毒也都能引起宿主細胞的內質網壓力。張堯助研究員的實驗團隊則嘗試從另一個方向思考,探討細胞的內質網壓力是否能反過來調控腫瘤病毒基因,誘發病毒致癌蛋白質的表現,因而進行此一系列的研究。
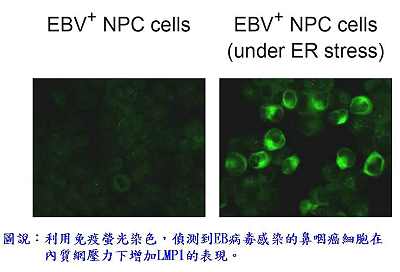
致癌蛋白質LMP1為EB病毒在潛伏感染期表現於細胞膜上的病毒蛋白質,它可透過刺激許多細胞訊息傳遞路徑,促進細胞生長、存活、進行侵襲性移動和血管新生。LMP1在鼻咽癌惡性發展過程中扮演重要角色,但其表現如何在鼻咽癌細胞中被調控,目前還不甚清楚。一般EB病毒感染的鼻咽癌細胞株並不大表現LMP1,研究團隊用誘發內質網壓力的藥物處理這些細胞後,發現病毒的LMP1 RNA及其蛋白質的表現量均明顯增加,內質網壓力也活化了LMP1基因的遠端啟動子TR-L1。團隊進一步在這個啟動子上找到一個內質網壓力反應區域,而且鑑定出該區域會跟一個UPR蛋白質的XBP-1結合。XBP-1是一種細胞轉錄因子,過度表現XBP-1可活化TR-L1並誘發LMP1的表現,利用小干擾RNA(small interfering RNA, siRNA)抑制XBP-1則會阻止LMP1的表現。研究團隊以免疫組織染色法檢驗鼻咽癌病人的腫瘤組織,也偵測到內質網壓力的標記,並且發現XBP-1與LMP1的表現呈顯著的正相關性,印證XBP-1是調控LMP1的重要因子。此外,研究還顯示內質網壓力所誘發的LMP1會促進鼻咽癌細胞分泌一種與腫瘤發展密切相關的細胞激素:介白素-8 (interleukin-8)。
上述研究揭露了內質網壓力在病毒相關癌症中的一項特別角色,即調控病毒致癌蛋白質的表現。EB病毒可以利用此分子機制,在感受到鼻咽癌細胞遭受內質網壓力時表現出LMP1,幫助宿主細胞在壓力下存活或生長,或促進腫瘤中的血管新生,紓解內質網壓力的根源(氧氣和養分的不足),甚至刺激癌細胞產生轉移,以脫離此壓力環境,這些現象均助長了腫瘤的惡化。因此,針對病毒相關的癌症,阻斷特定的UPR或許能抑制該UPR對癌細胞的保護,還可能阻止病毒致癌蛋白質的表現,在臨床治療上的應用值得進一步評估。
《文/圖:感染症研究組張堯助研究員》