NHRI Communications

健康知識
幹細胞:小型核糖核酸的大作用
Stem Cells: Big roles for small RNAs
 胚胎幹細胞除了可產生許多自己的複製體外,也可長成體內幾乎任何類型的細胞。被稱為微型核糖核酸(microRNAs)的微小基因調控因子,近來被發現可引導上述這些幹細胞的特性。Melton、Judson和Blelloch三位學者在2010年2月份Nature期刊所發表的研究指出,microRNAs在幹細胞生物學與未來幹細胞相關治療中扮演了決定性的角色,這項研究不但引起再生醫學及癌症醫學領域的關注,也使這種RNA微小分子前途無量。
胚胎幹細胞除了可產生許多自己的複製體外,也可長成體內幾乎任何類型的細胞。被稱為微型核糖核酸(microRNAs)的微小基因調控因子,近來被發現可引導上述這些幹細胞的特性。Melton、Judson和Blelloch三位學者在2010年2月份Nature期刊所發表的研究指出,microRNAs在幹細胞生物學與未來幹細胞相關治療中扮演了決定性的角色,這項研究不但引起再生醫學及癌症醫學領域的關注,也使這種RNA微小分子前途無量。我們體內幾兆個特化的細胞皆源自於一個受精的單細胞胚胎,幾個世紀以來,它的增生與特化過程不斷地吸引發育生物學家的目光。以回復編整(reprogramming)的人為方式促使成熟且已分化的細胞回到其初始狀態的能力,被視為是再生醫學十分具有潛力的工具,也可增進我們對生物發育過程的了解。
胚胎幹細胞有非凡的快速分裂能力,可自我增生(self-renew),製造許多幹細胞的複製體,也具有分化多能性(pluripotency),可分化為各種類型的特化細胞。分化後的細胞會表現出一組由基因編碼調控的因子,抑制細胞自我增生並封鎖(seal)已分化的狀態。我們對於分化多能性與分化狀態之間變換的特性仍然只有非常初淺的了解,但是有數個重要的調控基因已知是在過程中所不可缺少的。當對皮膚細胞等已分化的細胞上以人為方式激發其表現時,這些調控基因的一個次基因組(subset)會編譯出一些所謂「幹細胞性因子(stemness factors)」的蛋白質,將這些細胞回復編整(reprogramming)到具分化多能性狀態,產生被誘導的分化多能性幹細胞(induced pluripotent stem cells, iPSCs)。在一個有趣的整合性研究中,諸多證據都顯示microRNA是上述變換現象中必要的因子。
MicroRNAs是我們基因體裡的一種微小RNA分子,它們並沒有被轉譯成蛋白質,而是經由與其他RNAs(特別是訊息RNA,也就是mRNAs)結合來調控基因的表現。MicroRNA與mRNA的結合會抑制mRNA被轉譯成蛋白質。人體內有數千個microRNAs調控著數千個mRNAs,形成一個複雜的網絡。
MicroRNAs是在對線蟲(Caenorhabditis elegans)進行研究時首次被發現的,當時發現microRNA基因lin-4和let-7發生突變時會導致幹細胞的成熟過程有所缺陷,缺少lin-4和let-7基因時,線蟲上皮幹細胞(epithelial stem cells,也稱為縫合細胞(seam cells))將無法從自我複製(self-renewing)狀態退出及進行分化。近期的研究發現在所有多細胞生物體內,microRNAs幾乎參與所有生物程序,包含發育、新陳代謝和老化,也參與許多人類疾病(尤其是癌症)的發展。
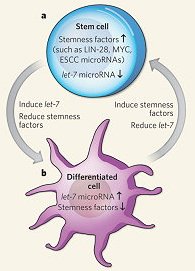
在細胞開始分化之前,let-7基因會在縫合細胞和哺乳動物幹細胞中表現microRNA,因此let-7被認為是一個預留的抗幹細胞性及促進分化因子,但它的作用機制仍尚未釐清。此次Melton等學者的研究證明, let-7的確是誘導小鼠胚胎幹細胞分化的關鍵因子,而且它似乎是促使具數種幹細胞性因子細胞減少的因素,這些細胞所帶有的幹細胞性因子基因及mRNAs都有眾多let-7結合區(binding sites),減少這些幹細胞性因子的數量可促進分化作用(如上圖)。此研究也發現另一組microRNAs基因家族可防止let-7促進分化作用。這些研究結果建構了一個模式的基礎,此模式主張不同類型的microRNAs會對胚胎幹細胞的命運有不同的影響,一類會促進自我增生,另一類則促進分化。
MicroRNAs要經過許多蛋白質的修飾後才具有完整的功能性。研究發現,線蟲的lin-28基因突變也會導致幹細胞過早分化,顯示LIN-28蛋白質(RNA結合蛋白質)也是一個幹細胞性因子,會抑制哺乳動物與線蟲let-7 microRNA的生成與成熟。研究中發現LIN-28對 iPSC的產生是不可缺的,很可能就在於其具有抑制let-7 microRNA成熟的能力。Melton的研究顯示抑制let-7可提高成熟細胞變成iPSC的產量,支持了上述模式的論點,也凸顯此microRNA在維持分化狀態上的重要性(如上圖)。
Melton等人的研究在再生醫學的應用上提出一個可利用暫時性地操控microRNA濃度促使iPSCs產生的方法,這個發現也同時引起癌症研究者的興趣,促成癌症研究一個新的假設,即幹細胞突變有可能會造成許多癌症,如果能運用操控上述microRNAs在腫瘤裡的表現數量,也許可作為未來新的抗癌療法。
原文:News and Views. Nature, 463: 616 (2010年2月4日發表)。
《文:編輯中心劉盈秀編譯;圖及資料來源:Nature期刊網站;審稿:分子與基因醫學研究組陳俊宏助研究員》