NHRI Communications

研究發展
B型肝炎病毒X抗原誘導肝癌的小鼠模型的共同監管基因之鑑定
NHRI researchers identify common regulators for hepatocellular carcinoma induced by hepatitis B virus X antigen in a mouse model
癌症的發生,牽涉到致癌基因(oncogenes)表現的增加,或是腫瘤抑制基因(tumor suppressor genes)表現的減少。而導致基因表現異常的原因很複雜,包括活化訊息傳遞路徑、DNA的擴增與減失、CpG島甲基化或去甲基化等。但目前為止,尚未有對癌症形成的各種過程作全面性、完整性及系統性的研究。B型肝炎病毒X抗原於人類肝細胞癌的發展扮演重要的角色;本院分子與基因醫學研究所喻秋華博士實驗室利用系統生物學的方法分析B型肝炎病毒X抗原誘導肝癌的小鼠模型,從肝癌初期、中期和後期各種基因體的變化,得到肝癌複雜的形成過程的全貌,並找出肝癌形成之前的關鍵基因。
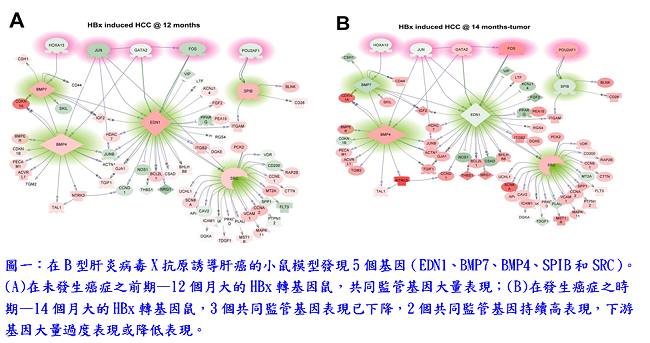
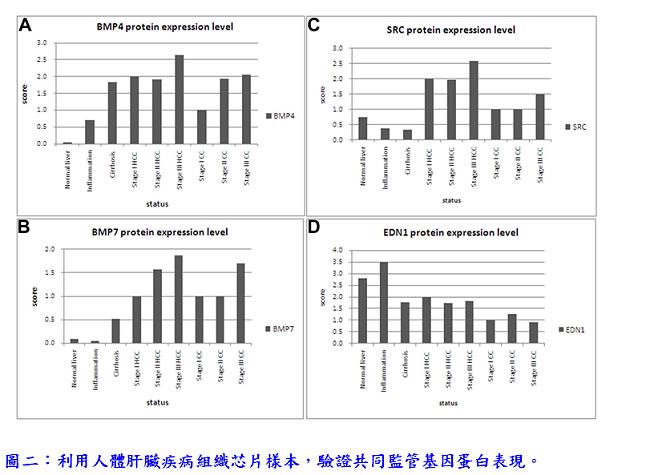
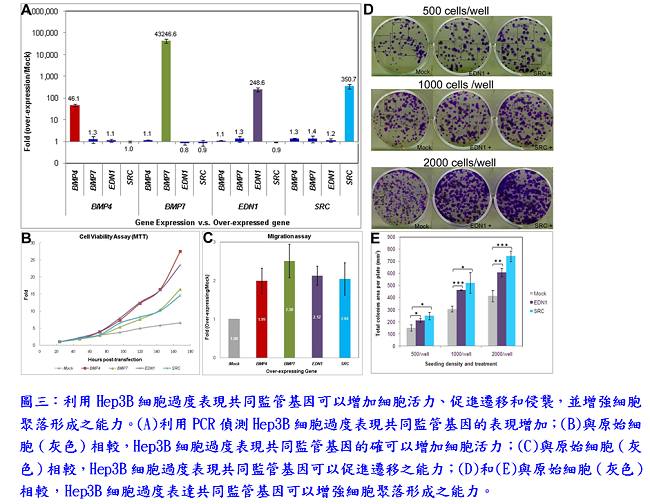
首先,研究團隊進行了全基因組基因表達分析,以此篩選過程來識別癌症時期差異表達的基因;並應用PathwayStudio之subnetwork分析,發現5個基因(EDN1、BMP7、BMP4、SPIB和SRC)在癌症前期的階段是共同監管基因(common regulators),可能藉由上調下游基因促進癌症發生(圖一)。在其他獨立的HBx轉基因小鼠株中,驗證這5個共同監管基因也有過度表現的情形。在人類肝癌檢體SRC和BMP4的過度表現從40%至67%不等;在帶有B型或C型肝炎病毒之肝癌患者檢體,BMP7、EDN1和SPIB均降低表現,可能顯示這些基因的過度表現發生在癌症形成前的階段,然後在癌症階段表現下降。此外,研究團隊利用人體肝臟疾病組織芯片樣本,驗證共同監管基因蛋白表現,在肝硬化時期,EDN1、BMP4和BMP7會大量表現,且BMP4、BMP7與SRC持續在肝癌或膽管癌中大量表現(圖二)。結果顯示共同監管基因表現的增加與人類肝癌的進展成正相關。在Hep3B細胞過度表現共同監管基因可以增加細胞活力、促進遷移和侵襲,並增強細胞聚落形成之能力(圖三)。
研究團隊在HBx誘導肝癌的小鼠模型中找出關鍵基因,利用人類肝癌檢體驗證RNA及蛋白質之表現並利用細胞株作功能檢測,喻秋華博士實驗室提議共同監管基因可作為肝癌早期診斷或治療的有用分子標靶。這是第一個利用肝癌小鼠模型,針對不同階段的肝癌作全基因組和系統性的研究。相關研究結果發表在Carcinogenesis 2012 Jan;33(1):209-219。
《文/圖:分子與基因醫學研究所喻秋華副研究員》