NHRI Communications

研究發展
本院研究發現Vav3調控前列腺癌轉移機制並可作為術後復發之預測因子
NHRI researchers report Vav3 regulates prostate cancer metastasis with elevated Vav3 expression correlating with prostate cancer progression and post-treatment recurrence
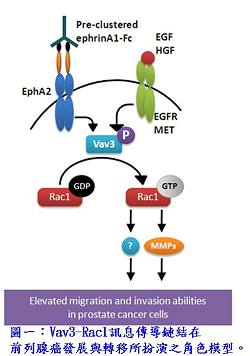 本院分子與基因醫學研究所王陸海特聘研究員帶領之實驗室與奇美醫院李健逢醫師合作,研究發現一種鳥嘌呤核苷酸交換因子─Vav3,在前列腺癌轉移的機制上扮演重要之角色;而在臨床檢體的分析中也發現此分子在復發病人的檢體中表現較高,有作為預後分子的潛力,此研究成果發表在國際癌症研究領域重要期刊Cancer Research(2012; 72; 3000-3009)。
本院分子與基因醫學研究所王陸海特聘研究員帶領之實驗室與奇美醫院李健逢醫師合作,研究發現一種鳥嘌呤核苷酸交換因子─Vav3,在前列腺癌轉移的機制上扮演重要之角色;而在臨床檢體的分析中也發現此分子在復發病人的檢體中表現較高,有作為預後分子的潛力,此研究成果發表在國際癌症研究領域重要期刊Cancer Research(2012; 72; 3000-3009)。前列腺癌在歐美國家的癌症致死率占男性的第二名,在台灣則為第七名,並有逐年上升的趨勢。前列腺癌病人的死亡往往是因為轉移所導致,因此抗轉移藥物的發展顯得十分重要。而由於目前針對前列腺癌轉移的治療藥物大多無法達到預期的效果,前列腺癌研究的其一重要議題便是探索前列腺癌轉移分子作用之機制,並且從中找出能幫助治療轉移病人的標的物。
因此,為了研究前列腺癌轉移的分子機制,本研究團隊發現,一種已知的致癌基因─Vav3,可經由Vav3-Rac1的訊息傳導鏈結影響前列腺癌細胞的移動與侵入能力。其機制為:在ligand的刺激之下,EphA2、EGFR或HGFR受器會被活化且吸引Vav3前來與之結合,進而活化Vav3;之後被活化的Vav3再進一步活化Rac1,因而增加前列腺癌細胞的移動與侵入能力(圖一)。而在小鼠的實驗模型上,本團隊使用原位癌移植的技術將PC3細胞送入裸鼠的前列腺之中,並就此觀察其腫瘤生長與轉移情形。發現在Vav3表現量降低的PC3細胞之中,不僅原位腫瘤生長速度較正常細胞為緩,其鄰近淋巴結與骨轉移的機率也大幅降低,顯示Vav3對前列腺癌的轉移機制扮演關鍵性的角色。此動物實驗使用的原位癌注射的技術優勢在於癌細胞在小鼠的轉移路線與前列腺癌病人相同,均是由鄰近淋巴結轉移至骨,因此可更精確地瞭解前列腺癌的轉移機制。
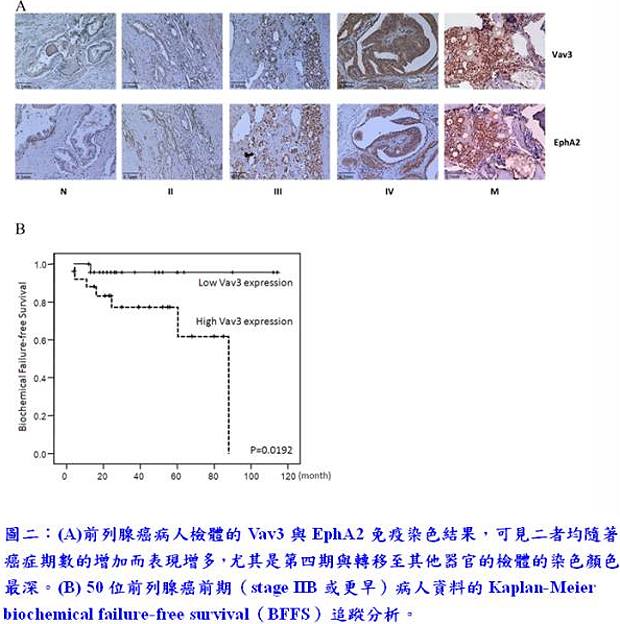
在臨床研究方面,本團隊與奇美醫院合作取得病人之檢體,並且發現在末期檢體(第四期原位癌)與轉移器官的檢體中有超過八成的切片過度表現Vav3與EphA2(圖二),比起正常組織與較為早期的檢體有大幅增加的趨勢。這些病理檢體的證據顯示,在有轉移現象的前列腺癌檢體中,Vav3與EphA2可能扮演重要的角色。另外將50位早期(stage IIB或更早期)前列腺癌病人的檢體做Vav3的染色,並使用病人follow-up 的結果,以此做Kaplan-Meier biochemical failure-free survival(BFFS)的追蹤分析,發現高表現Vav3的病人有較高的機率(60%)會復發;而相較於高表現Vav3的病人,低表現Vav3的病人則是幾乎都沒有復發的現象,顯示Vav3可能可以成為前列腺癌預測復發的預後分子(圖二);同時,針對Vav3的抑制物也可能成為治療前列腺癌轉移的潛力藥物。
《文/圖:分子與基因醫學研究所林愷悌博士後研究員》