NHRI Communications

研究發展
小分子新藥研發:探討活性藥物成分(API)溶解度和生體可利用率之關係
NHRI researcher investigates relationship between active pharmaceutical ingredient (API) solubility and bioavailability
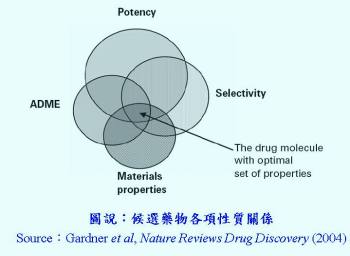 由於生技製藥產業開發成本甚高,在新藥探索及研發階段採取創新策略以加速藥物的研發時程,可降低開發成本。新藥能夠成功上市與許多關鍵因素息息相關,例如候選藥物之生體可利用率(bioavailability)即為重要的評估要素。如何透過物理方式、化學結構修飾及製劑配方調整,進而增加活性藥物成分(active pharmaceutical ingredient, API)溶解度,提升生體可利用率,使藥品發揮最佳療效,各研究發展單位有其獨特技術及評估策略。一般而言,新藥探索可分為兩個階段,第一個階段稱為「先導結構最適化」,其次是所謂的「候選藥物」階段。先導結構階段涉及選擇最佳的藥物分子,而候選藥物階段則意味著選擇最佳的固體形式。特定固體藥物配方的選擇用於特定固體藥物配方的最適化的活性藥物成分(API)。一般而言,對於病人來說,一個最佳藥物必須是安全、有效及價格不貴。因此最適化之候選藥物包括藥物之強度(potency)、選擇性(selectivity)、藥動特性(ADME)及API物質本身性質(material properties)(圖 1)。其中,最適化的API屬性包括溶解度、溶離速率和滲透率,且其與藥動特性之生體可利用率密切相關。
由於生技製藥產業開發成本甚高,在新藥探索及研發階段採取創新策略以加速藥物的研發時程,可降低開發成本。新藥能夠成功上市與許多關鍵因素息息相關,例如候選藥物之生體可利用率(bioavailability)即為重要的評估要素。如何透過物理方式、化學結構修飾及製劑配方調整,進而增加活性藥物成分(active pharmaceutical ingredient, API)溶解度,提升生體可利用率,使藥品發揮最佳療效,各研究發展單位有其獨特技術及評估策略。一般而言,新藥探索可分為兩個階段,第一個階段稱為「先導結構最適化」,其次是所謂的「候選藥物」階段。先導結構階段涉及選擇最佳的藥物分子,而候選藥物階段則意味著選擇最佳的固體形式。特定固體藥物配方的選擇用於特定固體藥物配方的最適化的活性藥物成分(API)。一般而言,對於病人來說,一個最佳藥物必須是安全、有效及價格不貴。因此最適化之候選藥物包括藥物之強度(potency)、選擇性(selectivity)、藥動特性(ADME)及API物質本身性質(material properties)(圖 1)。其中,最適化的API屬性包括溶解度、溶離速率和滲透率,且其與藥動特性之生體可利用率密切相關。藥物傳遞的主要目的是達到有效血中藥物濃度,有許多不同方法可達到此目的,例如靜脈滴注直接進入體循環,然而,大部分的藥物如口服錠片、膠囊等均藉由血管外途徑進入體内,其優勢在於口服劑型較其他劑型方便投藥、穩定性較佳、更廉價的生產成本和簡易方便的製程等。而難溶性藥物口服劑型的缺點為不易吸收,從而導致降低藥物療效。因此,改進藥物溶解度進而增加其生體可利用率是口服藥物開發過程最具挑戰性的課題。從胃腸道給予的口服藥物治療的成功先決條件之一,即是足夠藥物腸道吸收。由控制藥物於腸道中溶出速率及溶解度,並確定藥物吸收達最大藥物濃度以及滲透係數( permeability coefficient),關乎藥物溶離速率及有效穿腸壁的藥物,進而達到全身血液循環。
「生體可利用率(bioavailability)」是指藥物經過肝臟及胃腸道後有多少比例可被身體吸收,影響生體可利用率的因素可以分為生理、物化、生物因素。API物化性質已被確定會影響化合物的口服吸收和藥物代謝。此外,溶解度和滲透作用為口服吸收的兩大基本決定因子。
在生技製藥業上,越來越常見低溶解度導致低口服生體可利用率的候選藥物。估計25%到30%的化合物在早期發展中的低口服生體可利用率是由低溶解度所產生。藥物的水溶解度是控制其藥物生體可利用率的一個關鍵參數。因此,在預配方(pre-formulation)和配方(formulation)研究的發展階段中有必要評估藥物之溶解度。控制藥物溶解度的主要理化因素是其結晶性和非極性。因此,從預配方的角度來看即是增加藥物的溶解度以降低其結晶程度,或者改變其溶解環境。另外,對難溶性藥物,正確的藥動實驗設計研究可以提供有價值的溶解度及生體可利用率資訊,對於藥物發展風險評估是致關重要的。不同配方會表現不同的藥動特性,例如,如果某些藥物於懸浮劑具合宜藥動特性結果,則可推測它可能具有發展成傳統固體劑型(錠劑和膠囊)的可行性。另一方面,如果一個難溶性藥物顯示不佳的生體可利用率,則發展傳統的固體劑型可能極具挑戰性。
API固態屬性物理性能會影響其溶解度、生體可利用率及化學穩定性。不同晶格能量與物理形態(非晶型、不同的多晶型或solvates)具不同物理性能。API固態屬性可能受一些物化性質的影響包括熔點、吸濕性、溶解度、溶離速率、物理和化學安定性、折射率、導熱、表面活性、密度、習性、機械和光學特性。生物製藥的屬性也可能受到影響。一般而言,提高API溶解度和生體可利用率方法,可利用修飾API結構,改變API物化性質形式及藥物配方的技術。通常用於改善難溶性藥物溶解度和生體可利用率的同時,也可利用不同的模式篩選,以評估藥物吸收的潛力,用來改善難溶性藥物和再提高生體可利用率的吸收。
然而,如何修飾API來改善口服吸收,進而增加生體可利用率呢?API修飾大致可簡單分為鹽類選擇、多晶型研究與粒度分析、粒子奈米化等,例如(a)修飾晶體習性(modification of crystal habit);(b)表面活性劑之溶解(solubulization by surfactants);(c)降低粒子大小(particle size reduction);(d)增列複雜系統(inclusion complex system);(e)藥物分散在載體(dispersions in carriers);(f)鹽的選擇(salt selection);(g)前驅藥物(prodrug)等方法。大部分方法均是經由降低藥物粒子結晶性及增加表面積來改善API溶解度,其中鹽形成是增加溶解性最常見和最有效的方法;當一種藥物形成鹽時,一種鹽的特定形式具特定的物化性質。對於被解離的有機溶質,更改系統的pH值是可能增加溶解度的最簡單和最有效的手段。在適當條件下,溶解性解離的藥物可以通過調節溶液的pH值呈指數級增加。一般情況下,鹽的酸性和鹼性藥物比其相應的酸或鹼基形式具有較高溶解度。因此,藉由鹽的形成增加溶解度是發展口服製劑最常見的一種做法。
一個新藥能夠成功上市確與許多關鍵因素環環相扣。在過去10年中,全球醫藥市場大幅擴展,其每年平均增長速度達9.1%,2011年銷售額已達美金9,190億。不管藥物API純度或是API於製劑產品中,藥品的API可以存在於各獨特品種的固體形態中,例如多晶型、水合物、鹽、共結晶和非晶態固體。正如前所敘述,由於每個固體形態通常會顯示其特有的熱、機械、物理和化學屬性,可深深地影響溶解度、溶出速率、藥動特性之生體可利用率、吸濕性、熔點、穩定性、可壓縮性和其他藥物性質。因此在藥物研究發展過程對於API性質如何影響溶解度和生體可利用率是不可或缺之一環。本院生技與藥物研究所具有新藥開發的實力,能透過結構修改及製劑調整提升先導化合物或候選發展藥物生體可利用率,針對候選發展藥物之活性、鹽類、晶型、前驅藥、藥動、藥理、毒性等因素,訂定小分子新藥篩選開發策略,研究並探討具潛力候選藥物之可開發性,並將候選發展藥物由前臨床推動至一期臨床研究。
《文:生技與藥物研究所葉燈光副研究員;圖:Nature Reviews Drug Discovery期刊》