NHRI Communications

研究發展
PROX1可藉由調控miR-9抑制E-cadherin的後轉錄表現,進而促進大腸癌細胞表皮間質轉換作用
Prospero homeobox 1 promotes epithelial-mesenchymal transition in colon cancer cells by inhibiting E-cadherin via miR-9
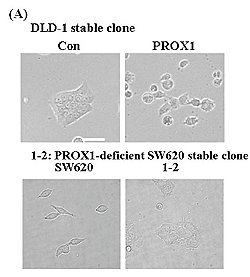 癌細胞的轉移是造成大腸癌病人死亡的最主要原因,而表皮間質轉換作用(epithelial-mesenchymal transition, EMT)的出現是代表癌細胞惡性化的表徵之一。筆者實驗室其中一個研究主題為探討prospero homeobox 1(PROX1)在大腸癌細胞表皮間質轉換中所扮演的分子調控機制。PROX1在演化中屬於高度保留性的轉錄因子,它可以調節神經前驅細胞、視網膜前驅細胞、淋巴上皮細胞及肝臟細胞的細胞分化。近期的研究指出PROX1在乳癌、肝癌及血癌中擔任腫瘤抑制基因的角色;另一方面,其在大腸癌、惡性星狀膠質細胞癌及卡波西氏血管內皮細胞癌中卻扮演加速腫瘤生長的腫瘤促進基因的角色。所以研究團隊好奇的是PROX1為何在不同癌症中具有截然不同的功能,且它是透過何種的分子機制去調控大腸癌惡性化表徵的形成。研究團隊最新的研究結果顯示PROX1的確具有促進癌細胞表皮間質轉換的能力,進而造成癌細胞惡性化表徵的出現(圖A)。
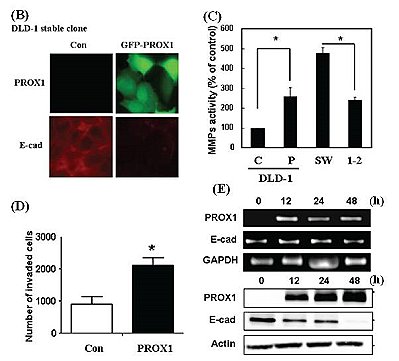
癌細胞的轉移是造成大腸癌病人死亡的最主要原因,而表皮間質轉換作用(epithelial-mesenchymal transition, EMT)的出現是代表癌細胞惡性化的表徵之一。筆者實驗室其中一個研究主題為探討prospero homeobox 1(PROX1)在大腸癌細胞表皮間質轉換中所扮演的分子調控機制。PROX1在演化中屬於高度保留性的轉錄因子,它可以調節神經前驅細胞、視網膜前驅細胞、淋巴上皮細胞及肝臟細胞的細胞分化。近期的研究指出PROX1在乳癌、肝癌及血癌中擔任腫瘤抑制基因的角色;另一方面,其在大腸癌、惡性星狀膠質細胞癌及卡波西氏血管內皮細胞癌中卻扮演加速腫瘤生長的腫瘤促進基因的角色。所以研究團隊好奇的是PROX1為何在不同癌症中具有截然不同的功能,且它是透過何種的分子機制去調控大腸癌惡性化表徵的形成。研究團隊最新的研究結果顯示PROX1的確具有促進癌細胞表皮間質轉換的能力,進而造成癌細胞惡性化表徵的出現(圖A)。在免疫組織的染色結果中,發現有高達43%的大腸癌組織中PROX1具有高度的表現。PROX1的表現和E-cadherin具有顯著的負相關而癌細胞的淋巴轉移能力及惡性化表徵則具有高度意義的正相關。為了進一步地釐清PROX1是否可直接藉由影響E-cadherin的表現,進而影響癌細胞本身的侵犯能力,該實驗室建構了DLD-1 PROX1 stable細胞株和SW620 PROX1-deficient細胞株進行一系列分子機轉的探討。利用一系列細胞功能性的分析下發現,DLD-1細胞在高度PROX1的表現下,會減少細胞中E-cadherin和integrins的表現,進而造成細胞與細胞間基質的附著能力下降(圖B);不僅如此,研究團隊還發現在PROX1的作用下也會伴隨增加細胞間質蛋白酶的表現(圖C),最終提高癌細胞本身的侵犯能力(圖D)。這些發現也進一步利用SW620 PROX1-deficient細胞株得到相呼應的結果。研究團隊確信PROX1之所以具有腫瘤促進基因的角色其中一個因素是因為它具有調控E-cadherin的能力。
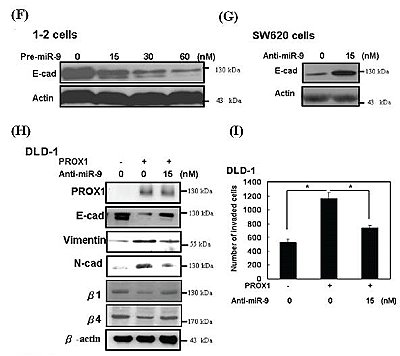
 研究團隊進一步地釐清PROX1調控E-cadherin的分子機制,因為PROX1本身是一種轉錄因子,所以,首先分析PROX1是否是藉由直接影響E-cadherin的轉錄作用。但出乎意料的是,PROX1雖然會影響E-cadherin mRNA的表現,但透過E-cadherin promoter的分析下,卻發現PROX1並不是藉由直接影響E-cadherin的轉錄作用,而是有可能藉由影響後轉錄作用來達到抑制E-cadherin的表現(圖E)。
研究團隊進一步地釐清PROX1調控E-cadherin的分子機制,因為PROX1本身是一種轉錄因子,所以,首先分析PROX1是否是藉由直接影響E-cadherin的轉錄作用。但出乎意料的是,PROX1雖然會影響E-cadherin mRNA的表現,但透過E-cadherin promoter的分析下,卻發現PROX1並不是藉由直接影響E-cadherin的轉錄作用,而是有可能藉由影響後轉錄作用來達到抑制E-cadherin的表現(圖E)。已知micro RNAs可以藉由抑制轉譯作用或造成mRNA的不穩定性來達到基因的後轉錄作用。透過文獻的報導指出miR-9具有調控E-cadherin的後轉錄的能力,因此研究團隊首先測試PROX1是否就是藉由提高miR-9的表現來達到對E-cadherin的負調控作用。結果顯示DLD-1在PROX1高表達的作用下,可以有效地促進細胞中miR-9的表現。而相呼應的是,在SW620細胞中也發現,當細胞缺少了PROX1的表現後,的確會顯著地抑制細胞中miR-9的表現。由以上的結果而大膽地推測,PROX1可能就是藉由影響miR-9的表現,進而達到對E-cadherin的抑制作用。為了驗證此假設,研究團隊將SW620中PROX1去表現後並同時給予pre-miR-9的前驅物,結果發現pre-miR-9可以有效地反轉PROX1對E-cadherin的負調控作用及細胞本身的侵犯能力。同樣的,也可以利用在DLD-1高表現PROX1下同時給予anti-miR-9而得到相對應的結果(圖F至圖I)。
 綜合以上的結果,研究團隊提出miR-9在PROX1對大腸癌細胞的表皮間質轉換和侵犯能力中扮演著重要角色。藉由瞭解PROX1在惡性化大腸癌的角色後,相信日後也許可以藉由利用PROX1在大腸中的角色作為治療大腸癌的指標。此研究結果刊登於12月Clinical Cancer Research期刊。
綜合以上的結果,研究團隊提出miR-9在PROX1對大腸癌細胞的表皮間質轉換和侵犯能力中扮演著重要角色。藉由瞭解PROX1在惡性化大腸癌的角色後,相信日後也許可以藉由利用PROX1在大腸中的角色作為治療大腸癌的指標。此研究結果刊登於12月Clinical Cancer Research期刊。《文/圖:癌症研究所洪文俊研究員兼副所長》