NHRI Communications

院務紀事
2013 NHRI Research Day優秀論文、壁報論文及優秀研究助理獎勵評選活動紀實
NHRI announces recipients of Research Day Awards for Outstanding Papers, Posters and Research Assistants
 為鼓勵本院年輕研究人員踴躍發表論文及獎勵優秀研究助理,特於3月19-20日假竹南院區舉辦「2013 NHRI Research Day」,以及優秀論文、壁報論文及優秀研究助理評選活動暨頒獎儀式。本年度投稿之壁報論文共計有167篇,依領域分為基礎醫學、應用醫學及臨床醫學/公衛3組;而本年度獲得單位推薦參與評選之優秀研究助理共計有29名。
為鼓勵本院年輕研究人員踴躍發表論文及獎勵優秀研究助理,特於3月19-20日假竹南院區舉辦「2013 NHRI Research Day」,以及優秀論文、壁報論文及優秀研究助理評選活動暨頒獎儀式。本年度投稿之壁報論文共計有167篇,依領域分為基礎醫學、應用醫學及臨床醫學/公衛3組;而本年度獲得單位推薦參與評選之優秀研究助理共計有29名。 評選方式乃由院內研究人員組成評選委員會進行評比。
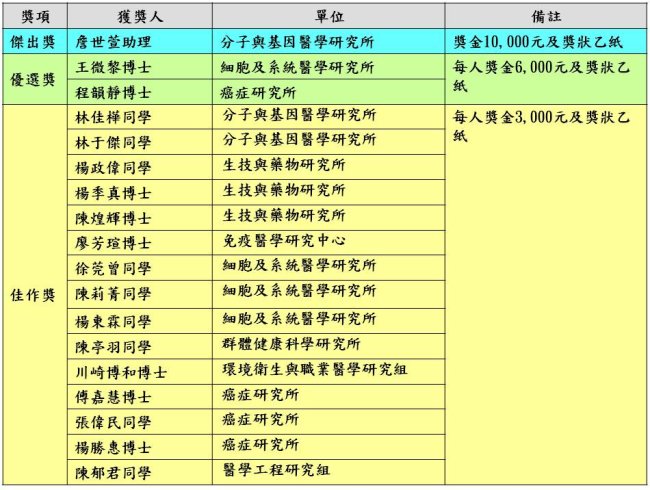
- 優秀論文:採三階段審查,第一階段初審為分組領域審查,擇優取前10%進入第二階段複審,前8名於Research Day進行英文口頭報告,競爭傑出及優選獎,其餘頒給佳作獎。各獎項共取18名。
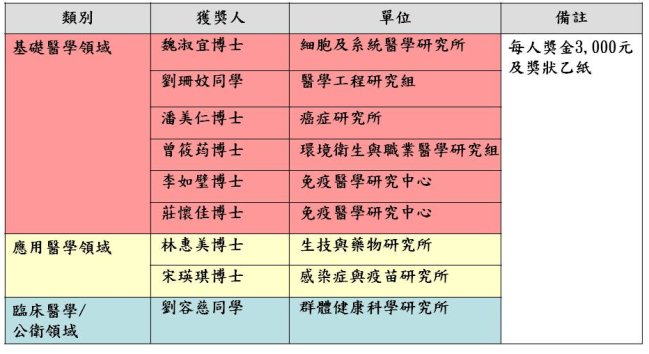
- 優秀壁報論文:除進行口頭報告者,其餘應張貼壁報論文,擇優取各領域前5%,共取9名(含同分者)。
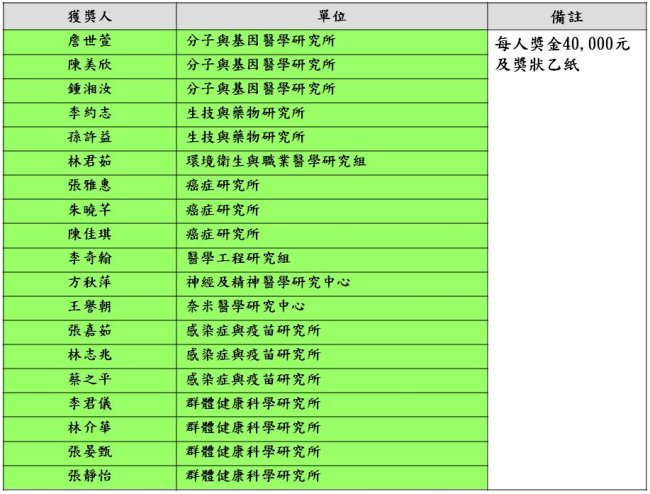
- 優秀研究助理:採二階段審查,第一階段由單位推薦、第二階段於Research Day進行評選,共計19名獲獎。
 詹世萱(傑出獎)
詹世萱(傑出獎)目前在分子與基因醫學研究所王陸海所長實驗室擔任研究助理工作。
研究主題為探討microRNA miR-149在乳癌轉移中所扮演的角色。利用小鼠模型,首先成功建立具有高度轉移性的乳癌細胞IV2。經由分析IV2細胞的microRNA表現圖譜,並鎖定一個功能未知的microRNA miR-149。研究發現,miR-149可以抑制乳癌細胞的體外爬行及侵襲能力。利用小鼠模型,發現miR-149能有效減少乳癌細胞的肺轉移能力。進一步的機轉性研究指出,miR-149透過負向調控下游標的基因GIT1表現進而抑制乳癌細胞的爬行、侵襲及肺轉移能力。重新表現GIT1可部分破壞由miR-149所造成的抑制現象。此外,研究發現抑制GIT1表現會破壞乳癌細胞的fibronectin-induced focal adhesion signaling,包括FAK和paxillin的磷酸化下降。其中抑制GIT1會造成paxillin和α5β1 integrin的蛋白質降解,最後導致乳癌細胞的focal adhesion complexes瓦解。此外,臨床檢體的分析發現,相較於早期(第一、二期)乳癌檢體,晚期(第三、四期)的乳癌檢體中表現較少的miR-149及較多的GIT1。同時,跟原位癌檢體相比,也發現淋巴轉移癌檢體表現較少的miR-149及較多的GIT1。總結來說,本篇研究發現miR-149/GIT1調控路徑有潛力可作為乳癌的預後指標,同時研究也提供了治療乳癌轉移的新方向,未來研究目標將會朝向將miR-149發展成乳癌轉移的新抑制劑。
王微黎(優選獎)
目前在細胞及系統醫學研究所裘正健研究員實驗室進行博士後研究。
研究主題探討miR-487A在血流剪力刺激血管內皮細胞增生時所扮演的角色。近來研究指出在較直血管中有高剪力單方向的層流,而在血管分歧處則有低剪力雙方向的擾流。擾流發生處常伴隨著血管內皮細胞的功能異變以及動脈硬化的發生。本實驗室已建立體外血流剪力系統,以此系統發現擾流會增加miR-487A的表現量。動物實驗在大鼠大主動脈血管內彎處(擾流發生處)可發現miR-487A有高度表現量,並且於患有動脈硬化的人類冠狀動脈組織切片也可發現miR-487A在內皮細胞有大量表現。以BrdU可嵌入增生細胞DNA的方法,發現擾流刺激下BrdU嵌入的細胞比例較多,加入miR-487A的拮抗劑抑制BrdU嵌入比例,過度表現miR-487A則增加BrdU嵌入比例。於動物實驗中以U型夾製造擾流區域並注射miR-487A拮抗劑可觀察到相同結果也證明miR-487A可調控內皮細胞的增生。已知擾流會引起BMP4/Smad的訊息傳遞途徑以促進細胞增生,本實驗亦觀察到miR-487A可受到smad5的調控促進其在擾流刺激下由primary轉變成功能性的mature形式,並活化下游的目標基因CBP及P53來調控如細胞週期控制因子cyclinA及p-Rb的表現。研究結果提供擾流參與動脈硬化發生的新分子機轉,可作為未來動脈硬化治療的標的。
程韻靜(優選獎)
目前在癌症研究所張俊彥所長實驗室進行博士後研究。
研究主題為探討新穎藥物MPT0B292如何透過調控微管乙醯轉移酶MEC-17(α-tubulin acetyltransferase enhancer, MEC-17)促進細胞微管乙醯化及抑制腫瘤生長、抗血管新生及抗轉移之探討。已知微管調控細胞內許多基本且重要的生理機制,包含細胞形狀、細胞內物質運輸、細胞的移動及胞器定位。目前研究中尚未釐清微管如何精準的調控細胞的各種不同生理活動。有報導指出,後修飾作用使得微管具有不同的特性,因此藉由研究微管特異化後修飾作用則提供了一個可能的機制以釐清微管如何調控不同生理活動。微管乙醯化程度主要經由細胞內的去乙醯酶(HDAC6)及乙醯轉移酶(MEC-17)所調控。MPT0B292造成細胞周期停滯(G2/M arrest),且促進ROS產生造成粒線體活性損傷(粒線體膜電位下降及細胞色素c釋放到細胞質)與啟動凋亡蛋白酶-9,進而誘發細胞凋亡。進一步的研究發現,MPT0B292具有促進細胞內微管乙醯化之能力,同時增加細胞內MEC-17的蛋白質表現;但不影響細胞內HDAC6的蛋白質表現及酵素活性。MPT0B292對於各種不同組織癌細胞及具抗藥性癌細胞都具有不錯的抑制生長能力(IC50 = 50-180 nM)。缺乏MEC-17(MEC-17 knowndown cells)的細胞,MPT0B292不能調控微管乙醯化,無法顯著地增加ROS濃度和誘發細胞凋亡。因此,本實驗室認為MPT0B292透控MEC-17調透微管乙醯化,增加ROS形成進而誘發細胞凋亡。除此之外,也發現MPT0B292具有抑制血管新生和轉移的能力。MPT0B292抑制人類臍帶靜脈內皮細胞的血管內皮細胞形態生成和移動。雞胚胎絨毛膜試驗中,MPT0B292顯著地抑制血管分支增生。MPT0B292可以顯著的增加細胞貼覆面積,增加細胞內FAK磷酸化的表現程度且抑制EMT的發生。在動物實驗中,不論是原位腫瘤或異位腫瘤移植模式,MPT0B292均呈現良好的抑制腫瘤生長的能力且具有降低血管密度及抑制轉移之能力。MPT0B292經由調控MEC-17影響細胞微管乙醯化並誘發細胞凋亡,進而降低癌細胞生長、轉移和血管新生。因此,在人類癌症的治療,MPT0B292是具有開發潛力的抗癌候選藥物。

優秀論文獲獎名單如下(依照單位順序排列):
優秀壁報論文獲獎名單如下(依照單位順序排列):
優秀研究助理獎勵獲獎名單如下(依照單位順序排列):
《文/圖:分子與基因醫學研究所詹世萱研究助理、細胞及系統醫學研究所王微黎博士、癌症研究所程韻靜博士提供;學術發展處蔡雨軒整理》