NHRI Communications

研究發展
小分子Aurora激酶抑制劑解開人類肝癌上調蛋白HURP在中心體和著絲粒微管成核作用中的機制
NHRI researchers unveil mechanisms of HURP in nucleation of centrosomal and kinetochore microtubules using novel Aurora kinase inhibitors
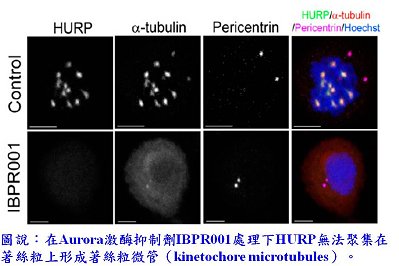 Aurora是一種serine/threonine激酶,其作用為調節細胞的有絲分裂進程(mitotic progression)、中心體的形成(centrosome maturation)與紡錘體的裝配(spindle assembly)。Aurora的過度表現與腫瘤生成有密切相關,因此,能抑制Aurora活性的小分子在癌症治療上的應用性已引起相當關注,一些Aurora抑制劑也已用於臨床試驗評估。微管成核作用(microtubule nucleation)在紡錘體裝配過程中扮演關鍵的角色,絲紡錘體需要正確連接著絲粒(kinetochore)才能進行後續的細胞分裂。目前已知微管成核作用需要中心體微管(centrosomal microtubules)和著絲粒微管(kinetochore microtubules)的相互配合1,然而哪些分子參與有絲紡錘體兩端微管成核作用與其機制卻未臻明瞭。本院細胞及系統醫學研究所紀雅惠助研究員與生技與藥物研究所(簡稱生技藥研所)謝興邦研究員、伍素瑩研究員跨所合作,利用生技藥研所研發的2個Aurora A抑制劑作為化學探針(chemical probe)來研究Aurora A與其受質人類肝癌上調蛋白(HURP)間的相互作用,並證明著絲粒和中心體微管成核作用中HURP分別處於磷酸化(HURP-P)和非磷酸化(HURP-U)的狀態,進而調節紡錘體形成。此發現刊登在2013年4月22日的美國國家科學院院刊(Proceedings of the National Academy of Science of the United State of America)。
Aurora是一種serine/threonine激酶,其作用為調節細胞的有絲分裂進程(mitotic progression)、中心體的形成(centrosome maturation)與紡錘體的裝配(spindle assembly)。Aurora的過度表現與腫瘤生成有密切相關,因此,能抑制Aurora活性的小分子在癌症治療上的應用性已引起相當關注,一些Aurora抑制劑也已用於臨床試驗評估。微管成核作用(microtubule nucleation)在紡錘體裝配過程中扮演關鍵的角色,絲紡錘體需要正確連接著絲粒(kinetochore)才能進行後續的細胞分裂。目前已知微管成核作用需要中心體微管(centrosomal microtubules)和著絲粒微管(kinetochore microtubules)的相互配合1,然而哪些分子參與有絲紡錘體兩端微管成核作用與其機制卻未臻明瞭。本院細胞及系統醫學研究所紀雅惠助研究員與生技與藥物研究所(簡稱生技藥研所)謝興邦研究員、伍素瑩研究員跨所合作,利用生技藥研所研發的2個Aurora A抑制劑作為化學探針(chemical probe)來研究Aurora A與其受質人類肝癌上調蛋白(HURP)間的相互作用,並證明著絲粒和中心體微管成核作用中HURP分別處於磷酸化(HURP-P)和非磷酸化(HURP-U)的狀態,進而調節紡錘體形成。此發現刊登在2013年4月22日的美國國家科學院院刊(Proceedings of the National Academy of Science of the United State of America)。HURP的主要功能是穩定著絲粒纖維(K-fibers),促進成核作用及微管的交叉交連2, 3。HURP原本位於中心體,在紡錘體形成時經由活化Aurora A促使HURP磷酸化,HURP被磷酸化後會移動至被Ran-GTP所調控的K-fibers 3,4 。然而HURP如何在中心體和著絲粒之間遷移,目前機制仍不清楚。在哺乳動物細胞中,因為HURP的表現與細胞週期非常有關聯,且僅侷限在細胞分裂的前期到中期,故無法利用RNAi或其他基因方法在特定細胞週期中快速抑制Aurora A活性來觀察HURP如何因磷酸化所進行的調節。VX-680是第一代的Aurora小分子抑制劑。之前已有學者研究在進行有絲分裂的細胞中添加VX-680,發現對HURP的定位並無影響5。而本研究團隊發現VX-680雖然會降低HURP磷酸化現象,然其在有絲分裂中卻未能有效地阻斷HURP的功能。本研究團隊利用自行研發的2個小分子(IBPR001與IBPR002),經測試後發現較VX-680更能有效抑制HURP磷酸化。晶體繞射X-ray結構顯示,Aurora A激酶與IBPR001作用的蛋白質結構與VX-680不同,這個結果有助於解釋IBPR001在調控Aurora A磷酸化HURP的反應與VX-680有所不同。IBPR001和IBPR002不僅有效地抑制有絲分裂細胞中HURP磷酸化作用,同時在大腸癌的動物實驗中發現其能降低腫瘤的形成。
Nocodazole是一種與β微管蛋白結合的小分子,可防止其雙硫鍵(disulfide linkages )的形成,進而抑制微管的組成和有絲分裂的進行。在300-400 nM濃度的nocodazole刺激下,微管只能在著絲粒成核,但無法在中心體形成,此原因目前尚未明瞭。研究團隊發現在此條件下,大於95%HURP會有磷酸化現象,而在IBPR001/IBPR002的刺激下,以共軛聚焦顯微鏡觀察發現著絲粒微管逐漸分解。這個結果驗證哺乳動物中,著絲粒微管的核化作用和HURP磷酸化作用有功能性的關聯。
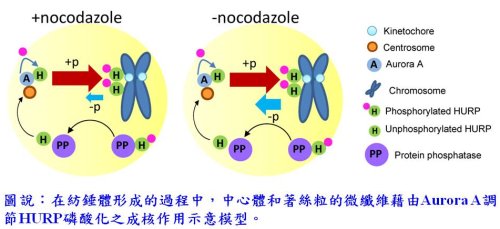 有趣的是,在nocodazole刺激下,HURP是以HURP-P形式呈現,而移除nocodazole下,HURP會重新分配在著絲粒和中心體微管;此結果顯示HURP-P可以轉換至HURP-U。另外研究中發現,加入蛋白磷酸酶1(PP1)和蛋白磷酸酶2A(PP2A)的抑制劑-Calyculin A,能阻斷IBPR001所調節的HURP去磷酸化作用,表示藉由Aurora A的磷酸化和PP1/PP2A的去磷酸化作用,HURP能在中心體和著絲粒之間循環,以建立有效的有絲分裂紡錘體。
有趣的是,在nocodazole刺激下,HURP是以HURP-P形式呈現,而移除nocodazole下,HURP會重新分配在著絲粒和中心體微管;此結果顯示HURP-P可以轉換至HURP-U。另外研究中發現,加入蛋白磷酸酶1(PP1)和蛋白磷酸酶2A(PP2A)的抑制劑-Calyculin A,能阻斷IBPR001所調節的HURP去磷酸化作用,表示藉由Aurora A的磷酸化和PP1/PP2A的去磷酸化作用,HURP能在中心體和著絲粒之間循環,以建立有效的有絲分裂紡錘體。研究團隊並發現加入IBPR001的細胞中,HURP比較容易與母中心體(mother centrosome)所延伸之微管結合,相對而言,HURP比較不容易附著在子中心體(daughter centrosome)延伸之微管。此HURP不對稱地附著在中心體微管的新發現,挑戰目前現存在的「哺乳動物細胞有絲分裂紡錘體產生對稱的兩個複製中心體之觀念」。團隊所研發之新化合物和其機制,提供新的論點,將有利於未來尋找新的細胞分裂分子及發展出新的抗腫瘤藥物。
References
- Maiato H, Rieder CL, and Khodjakov A. Kinetochore-driven formation of kinetochore fibers contributes to spindle assembly during animal mitosis. Journal of Cell Biology. 2004;167, 831-840.
- Koffa MD, Casanova CM, Santarella R, Kocher T, Wilm M, and Mattaj IW. HURP is part of a Ran-dependent complex involved in spindle formation. Current Biology. 2006;16, 743-754.
- Sillje HH, Nagel S, Korner R, and Nigg EA. HURP is a Ran-importin beta-regulated protein that stabilizes kinetochore microtubules in the vicinity of chromosomes. Current Biology. 2006;16, 731-742.
- Yu CT, Hsu JM, Lee YC, Tsou AP, Chou CK, and Huang CY. Phosphorylation and stabilization of HURP by Aurora-A: implication of HURP as a transforming target of Aurora-A. Molecular and Cellular Biology. 2005;25, 5789-5800.
- Wong J, Lerrigo R, Jang CY, and Fang G. Aurora A regulates the activity of HURP by controlling the accessibility of its microtubule-binding domain. Molecular and Cellular Biology . 2008;19, 2083-2091.
《文/圖:細胞及系統醫學研究所謝依霖、紀雅惠助研究員、生技與藥物研究所謝興邦研究員、伍素瑩研究員》