NHRI Communications

研究發展
本院幹細胞研究團隊找到間質幹細胞調節免疫關鍵因子--肝臟生長因子
NHRI researchers discover multipotent mesenchymal stromal cells mediate the expansion of myeloid-derived suppressor cells through the HGF/c-met axis and STAT3
 本院細胞及系統醫學研究所顏伶汝副研究員繼2005年領先全球從胎盤間質幹細胞分化出神經細胞,又於2010年利用胎兒臍帶血管內皮細胞成功製造出「萬能幹細胞」,今年與癌症研究所劉柯俊副研究員及國防醫學院司徒惠康院長合作,再次成功於間質幹細胞中找到調節自體免疫的關鍵機制。此成果於7月25日刊登於世界頂尖Cell期刊相關系列最新幹細胞研究領域雜誌Stem Cell Reports。
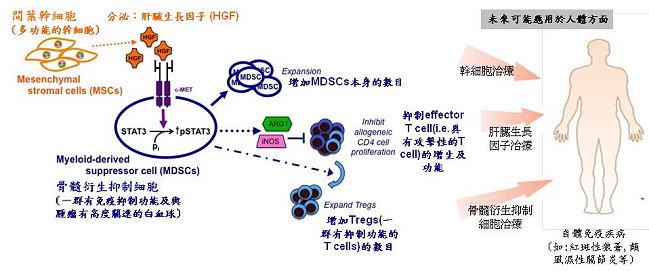
本院細胞及系統醫學研究所顏伶汝副研究員繼2005年領先全球從胎盤間質幹細胞分化出神經細胞,又於2010年利用胎兒臍帶血管內皮細胞成功製造出「萬能幹細胞」,今年與癌症研究所劉柯俊副研究員及國防醫學院司徒惠康院長合作,再次成功於間質幹細胞中找到調節自體免疫的關鍵機制。此成果於7月25日刊登於世界頂尖Cell期刊相關系列最新幹細胞研究領域雜誌Stem Cell Reports。顏伶汝副研究員研究團隊發現,間質幹細胞可藉由分泌「肝臟生長因子(HGF)」,增加來自骨髓之免疫抑制細胞的數目,從而抑制具有攻擊性T淋巴細胞(effector T cell)的增生,並提高能避免免疫反應過度損傷身體的調節性T淋巴細胞(regulatory T cell)的數量,有效降低人體免疫細胞的過度表現。這項發現未來將可透過不同方式增強肝臟細胞生長因子之作用,達到降低異常自體免疫反應的效果,對於困擾許多人的紅斑性狼瘡、類風濕性關節炎等自體免疫疾病,可以開啟一個全新的治療方向。
自體免疫疾病是一種人體內自己的免疫系統攻擊自己身體正常細胞的疾病,原本應扮演防禦角色的細胞在轉錄因子過度活化刺激下,產生大量發炎相關之細胞激素,因而攻擊自體的健康組織及器官,造成發炎性多重系統慢性疾病,至今尚未能獲得確實治療或控制。存在於人體組織中的間質幹細胞,近年來隨著分子生物學及細胞生物學的快速進展,間質幹細胞的研究也快速進展,特別是它能增加調節性T淋巴細胞和耐受性樹突細胞等有免疫抑制性白血球的免疫調節功能,而倍受關注。
儘管早已知曉間質幹細胞的免疫抑制調節功能,但是其作用機制卻不明。顏伶汝副研究員研究團隊首先發現人類間質幹細胞能增加CD14-/CD11b+/CD33+「骨髓衍生抑制細胞(MDSCs)」的數目。骨髓衍生抑制細胞是一群由骨髓幹細胞衍生而來的先驅細胞,具有抑制免疫反應的能力。研究團隊進一步發現,間質幹細胞能增加骨髓衍生抑制細胞數量的機制是透過間質幹細胞所分泌的肝臟細胞生長因子。其所產生的骨髓衍生抑制細胞都有很強的免疫抑制功能,除自體免疫的抑制功能之外,尚包含抑制異體淋巴細胞增殖,以及增加近二倍調節性T淋巴細胞之數量。
研究團隊透過單獨外加肝臟細胞生長因子的方法,可觀察到骨髓衍生抑制細胞數目有明顯的增加,數量高達2倍左右。而在活體裡,研究團隊利用野生型小鼠,發現小鼠肝臟的確含有高量的骨髓衍生抑制細胞,而當肝臟細胞生長因子的受體(c-Met)在老鼠活體內被抑制,肝臟裡70%的骨髓衍生抑制細胞便會大量降低,證明肝臟生長因子及其受體(HGF/c-Met)在維持此白血球的重要性。此外,直接注射肝臟細胞生長因子於老鼠體內,骨髓衍生抑制細胞之數量也會明顯增加30%,充分證實研究的可靠性。
藉由間質幹細胞分泌之肝臟細胞生長因子增加骨髓衍生抑制細胞數目的機制,須有肝臟細胞生長因子受體c-Met參與,且下游磷酸化轉錄訊息傳遞及活化子蛋白及轉錄因子STAT3為增加骨髓衍生抑制細胞之關鍵路徑。研究結果指出,間質幹細胞具有加強免疫調節性質,亦說明肝臟細胞生長因子在擴張骨髓衍生抑制細胞所扮演的角色。肝臟生長因子及其受體(HGF/c-Met)目前已是許多癌症的治療標靶之一,而STAT3不但是與發炎疾病有高度相關的轉錄因子,也是與許多癌症的產生有關,因此本研究也闡明一個可藉由逆轉癌症中之免疫抑制機制而治療癌症的新穎途徑。
根據這項研究結果推論,藉由增加肝臟細胞生長因子之作用或促進間質幹細胞表現肝臟細胞生長因子等方法,將可有效抑制或調控自體免疫疾病患者體內的異常免疫反應,為自體免疫疾病找到嶄新的醫治新方向。目前此研究還在研發階段,臨床應用還需要後續的實驗確認。
《文:秘書室賴瑨萱、細胞及系統醫學研究所顏伶汝副研究員、癌症研究所劉柯俊副研究員;圖:秘書室周怡利、顏伶汝副研究員、徐佩茹研究助理》