NHRI Communications

研究發展
本院完成第一階段H7N9疫苗株馴化並選出優質H7N9疫苗株(RG-268)
The NHRI cGMP Vaccine Plant has successfully completed adapation study to choose the ideal H7N9 vaccine
 H7N9新型流感在今年冬天或明年可能引起全球疫情。世界衛生組織(WHO)、美國、日本與歐盟也開始準備H7N9疫苗之製備及抗病毒藥物的儲備。台灣因地處H7N9原始發源地中國東南諸省,因此衛生福利部於今(2013)年6月也開放2個研究計畫,進行台灣政府H7N9疫苗的製備。此2計畫包括蛋(egg-based)及細胞培養(cell-based)疫苗,各獲政府提供新台幣3,500萬元預算進行研發,以通過新藥審查(IND)並完成第二期臨床試驗為標的,預計2014年3月完成臨床前開發,同年6月完成第二期臨床試驗。
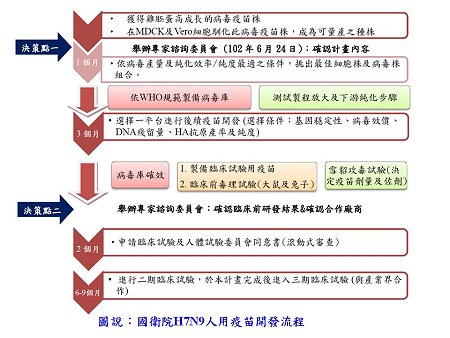
H7N9新型流感在今年冬天或明年可能引起全球疫情。世界衛生組織(WHO)、美國、日本與歐盟也開始準備H7N9疫苗之製備及抗病毒藥物的儲備。台灣因地處H7N9原始發源地中國東南諸省,因此衛生福利部於今(2013)年6月也開放2個研究計畫,進行台灣政府H7N9疫苗的製備。此2計畫包括蛋(egg-based)及細胞培養(cell-based)疫苗,各獲政府提供新台幣3,500萬元預算進行研發,以通過新藥審查(IND)並完成第二期臨床試驗為標的,預計2014年3月完成臨床前開發,同年6月完成第二期臨床試驗。本院感染症與疫苗研究所(感疫所)cGMP生物製劑廠獲得細胞培養計畫,並於今年7月針對美國CDC提供的RG-32A(上海第二型H7N9)疫苗株,同時於MDCK及Vero細胞株進行培養及馴化。此外,自8月中起本院台南「成大病毒合約實驗室」由王貞仁教授及王雅芳博士領導,而竹南感疫所BSL-2病毒室由李敏西博士及胡勇誌博士同時進行英國N1BRG兩株疫苗株(RG267、RG268)在MDCK的生長評估。此期間3個實驗室同時測試不同培養基Optipro SFM及plus MDCK SFM的優劣。
經3組實驗室同時進行馴化、評估血液凝集抗原(HA)力價及病毒生長(TCID50),經繼代培養,RG-32A需到第五至七代方能達到HA512及TCID50 107的病毒數,而RG268則在第三代即可達到上述這些標準,這二株馴化的疫苗株皆符合良好的標準株。最後經專家會議依生長條件及智財權之考量,而選訂RG268(安徽株),MDCK細胞株,為第二階段製程的依據。
經此一階段的科學研判,本院細胞培養H7N9疫苗製備預計將可順利於明年3月底完成IND。第二階段工作將於2014年11月完成病毒庫確效並製備臨床試驗用疫苗,進行毒理試驗、雪貂免疫力及保護力,以及佐劑(Al(OH)3及MF59)之選用。本計畫預訂2014年2月舉行包含WHO專家在內的第二次決策會議審查所有資料,並預訂2014年3月申請臨床試驗IND核可。
本院感疫所此次動員3組人力同時針對3組疫苗株、2組細胞株、2組培養基,以及2組佐劑進行最佳化的疫苗製備,顯現了感疫所動員能力、學術力及團隊能力。感疫所一直以提供優質及安全的疫苗為目標,並與國際科學界及WHO接軌為標的,展現台灣的科學及生技實力。今年10月WHO已建議安徽株為最佳疫苗株,與我們所選定的RG268同。在此感謝感疫所同仁、cGMP工作團隊、本院行政人員、台灣學界,以及三峽預醫所與進階公司之合作。本院將選出合作廠商共同執行臨床前研究,並執行臨床試驗。
《文/圖:感染症與疫苗研究所蘇益仁所長》