NHRI Communications

研究發展
肝特異性表達的HBx和SRC在p53突變斑馬魚引發肝癌
NHRI researchers demonstrate liver-specific expressions of HBx and SRC in the p53 mutant trigger hepatocarcinogenesis in zebrafish
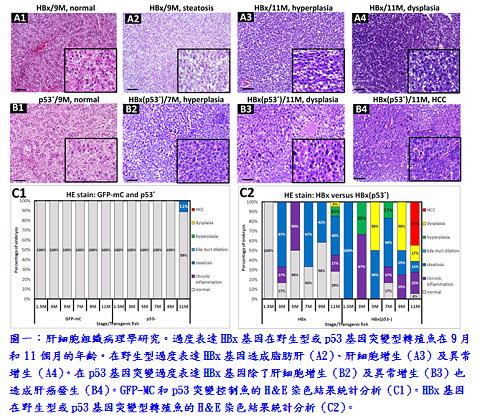 本院分子與基因醫學研究所喻秋華副研究員實驗室團隊研究發現,B型肝炎病毒X抗原(HBx)和p53突變有協同作用,在11個月齡的斑馬魚誘發肝細胞增生及肝癌形成。大量表現src基因在p53突變的斑馬魚,比單獨表現src基因時,可加速肝癌形成。而於臨床檢體的分析中,在80例惡性腫瘤,有10種腫瘤類型其SRC蛋白皆過度表達,此10種包括乳癌、腦癌、大腸癌、食管癌、腎癌、肝癌、肺癌、前列腺癌、胃癌和子宮癌。研究結果表明,SRC在mRNA和蛋白水平的過度表達,不僅在肝癌的形成,也在各種人類癌症的形成扮演一個重要角色。此研究成果已被國際知名期刊PLoS ONE所接受(2013 Aug)。
本院分子與基因醫學研究所喻秋華副研究員實驗室團隊研究發現,B型肝炎病毒X抗原(HBx)和p53突變有協同作用,在11個月齡的斑馬魚誘發肝細胞增生及肝癌形成。大量表現src基因在p53突變的斑馬魚,比單獨表現src基因時,可加速肝癌形成。而於臨床檢體的分析中,在80例惡性腫瘤,有10種腫瘤類型其SRC蛋白皆過度表達,此10種包括乳癌、腦癌、大腸癌、食管癌、腎癌、肝癌、肺癌、前列腺癌、胃癌和子宮癌。研究結果表明,SRC在mRNA和蛋白水平的過度表達,不僅在肝癌的形成,也在各種人類癌症的形成扮演一個重要角色。此研究成果已被國際知名期刊PLoS ONE所接受(2013 Aug)。 根據衛生福利部公布國人十大死因,癌症連續30年居首,而肝癌在十大癌症死因排名第二,其中肝細胞癌(hepatocellular carcinoma, HCC)約占了肝癌的90%。早期肝癌無明顯症狀,這也是造成肝癌死亡率高的主要原因之一。在治療方面,由於肝癌具有相當的抗藥性,目前為止,仍無有效的化療方法證實能延長病患的壽命,因此,研發新的藥物來治療肝癌乃是迫切需要的。在亞洲絕大部分的肝癌是因為感染了B型或C型肝炎病毒,歷經肝炎、脂肪肝、肝纖維化、肝硬化,最後發展成為肝癌。喻博士實驗室團隊先前利用B型肝炎病毒X抗原誘導肝癌的小鼠模式,找出4個肝癌形成的關鍵基因,可作為未來肝癌早期診斷或治療的有用分子標靶。4個關鍵基因包含EDN1、BMP7、BMP4與src。相較於小鼠模式,斑馬魚模式是一個成本較低和更快的檢測系統,近年來斑馬魚已成新興的癌症研究及藥物篩選模式動物;因此,研究團隊利用基因轉殖技術,建立了肝癌的斑馬魚模式,研究肝癌發生的機制,並利用此斑馬魚基因改造疾病模式作為高通量藥物篩選平台。
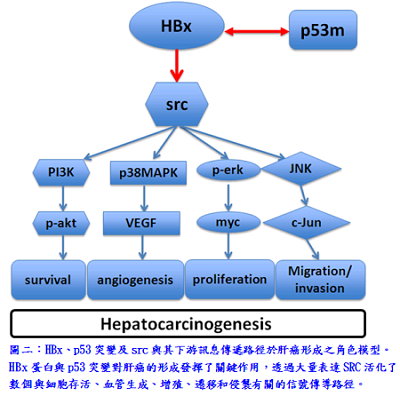 過去研究指出,在亞洲有80%的肝癌是由於B型肝炎病毒感染造成的,60%的肝癌患者有SRC大量表達,且60%的肝癌患者有p53基因在特定位點發生突變。促進肝癌形成病因很多,包括B型肝炎病毒X抗原、SRC和p53突變,然而,目前仍不清楚它們之間潛在的協同效應和促進肝癌的機制。研究團隊利用轉殖基因斑馬魚模式,表明B型肝炎病毒X抗原與p53突變具協同作用,在斑馬魚中透過SRC的活化觸發肝癌的形成。在野生型斑馬魚的肝臟特異表達B型肝炎病毒X抗原引起脂肪肝、肝纖維化和肝醣累積。然而,在p53基因突變的魚B型肝炎病毒X抗原誘導腫瘤形成,同時src酪氨酸激酶表現上升及激活信號通路。此外,src的過度表達在p53突變的斑馬魚也引起肝細胞增生及肝癌形成,伴隨著P-ERK、P-AKT、MYC、JNK1和VEGF表現增加。HBx(p53-)成src(p53-)轉殖基因斑馬魚,在早期階段,檢測到脂質生合成因子、脂質代謝和肝醣儲積有關的基因表達水平增加;轉殖基因斑馬魚在後期階段,涉及細胞週期調控,腫瘤進展和其他肝癌的分子標誌上調基因大量表達。綜合以上研究表明,在p53突變的斑馬魚過度表達B型肝炎病毒X抗原或是SRC可誘導肝癌。這種現象與人類肝癌形成的機制非常類似,將為治療人類肝癌提供了潛在的藥物篩選平台。
過去研究指出,在亞洲有80%的肝癌是由於B型肝炎病毒感染造成的,60%的肝癌患者有SRC大量表達,且60%的肝癌患者有p53基因在特定位點發生突變。促進肝癌形成病因很多,包括B型肝炎病毒X抗原、SRC和p53突變,然而,目前仍不清楚它們之間潛在的協同效應和促進肝癌的機制。研究團隊利用轉殖基因斑馬魚模式,表明B型肝炎病毒X抗原與p53突變具協同作用,在斑馬魚中透過SRC的活化觸發肝癌的形成。在野生型斑馬魚的肝臟特異表達B型肝炎病毒X抗原引起脂肪肝、肝纖維化和肝醣累積。然而,在p53基因突變的魚B型肝炎病毒X抗原誘導腫瘤形成,同時src酪氨酸激酶表現上升及激活信號通路。此外,src的過度表達在p53突變的斑馬魚也引起肝細胞增生及肝癌形成,伴隨著P-ERK、P-AKT、MYC、JNK1和VEGF表現增加。HBx(p53-)成src(p53-)轉殖基因斑馬魚,在早期階段,檢測到脂質生合成因子、脂質代謝和肝醣儲積有關的基因表達水平增加;轉殖基因斑馬魚在後期階段,涉及細胞週期調控,腫瘤進展和其他肝癌的分子標誌上調基因大量表達。綜合以上研究表明,在p53突變的斑馬魚過度表達B型肝炎病毒X抗原或是SRC可誘導肝癌。這種現象與人類肝癌形成的機制非常類似,將為治療人類肝癌提供了潛在的藥物篩選平台。《文/圖:分子與基因醫學研究所盧正偉博士生、喻秋華副研究員》