NHRI Communications

研究發展
於腫瘤細胞始活化的鉑金藥物
NHRI researchers discover caged Pt nanoclusters can exhibit corrodibility to exert tumor-inside activation for anticancer chemotherapeutics
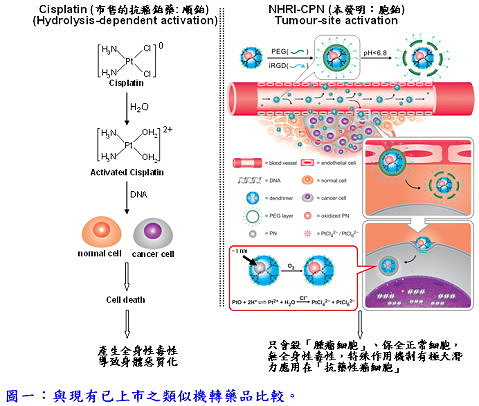 本院生醫工程與奈米醫學研究所林淑宜副研究員研究團隊發展了一種新型鉑金藥物(稱為「胞鉑(NHRI-CPN)」),具有「於腫瘤細胞始活化」的特殊功能,也就是只毒殺腫瘤細胞,保全正常細胞,因此可以避免化療導致身體的惡質化。「胞鉑 」具有類似現市售的抗癌鉑藥「順鉑(cisplatin)」 的功能,但不會產生嚴重的副作用。「胞鉑 」是利用新穎的合成方式提供大小約1 nm的奈米鉑,大約由35顆鉑原子組成,其中約有90%的鉑原子是暴露奈米鉑表面,因此增加鉑原子和氧氣接觸的機會,形成可以溶解的「氧化奈米鉑」,之後在癌細胞的弱酸且有氯離子的環境中,即可能成為離子態,與癌細胞的DNA形成錯合物,致使癌細胞凋亡。此研究成果已發表於材料跨領域學門指標期刊Advanced Materials(doi: 10.1002/adma.201302363, impact factor: 14.829)。
本院生醫工程與奈米醫學研究所林淑宜副研究員研究團隊發展了一種新型鉑金藥物(稱為「胞鉑(NHRI-CPN)」),具有「於腫瘤細胞始活化」的特殊功能,也就是只毒殺腫瘤細胞,保全正常細胞,因此可以避免化療導致身體的惡質化。「胞鉑 」具有類似現市售的抗癌鉑藥「順鉑(cisplatin)」 的功能,但不會產生嚴重的副作用。「胞鉑 」是利用新穎的合成方式提供大小約1 nm的奈米鉑,大約由35顆鉑原子組成,其中約有90%的鉑原子是暴露奈米鉑表面,因此增加鉑原子和氧氣接觸的機會,形成可以溶解的「氧化奈米鉑」,之後在癌細胞的弱酸且有氯離子的環境中,即可能成為離子態,與癌細胞的DNA形成錯合物,致使癌細胞凋亡。此研究成果已發表於材料跨領域學門指標期刊Advanced Materials(doi: 10.1002/adma.201302363, impact factor: 14.829)。以化學療法治療惡性腫瘤時,有一半以上的療程會用到主要成分為鉑金的藥物。其中最有名的就是「順鉑」;但是,一旦將此類藥物注射入體內之後,就會被水分子活化而產生毒性(hydrolysis-dependent activation),在抑制癌細胞的同時也毒害全身的健康細胞,產生全身性毒性的問題。相對而言,「胞鉑」進入人體之後不會立刻發生水解活化,經胞吞作用,進入癌細胞之後,才開始有效地活化成具有毒性的鉑離子,發揮抑制癌細胞的功效。也就是「胞鉑」係為一種具有「於腫瘤始活化」的治療藥物,控制使其在腫瘤細胞中始發揮藥性(毒性),可避免產生全身性的毒性,可大幅減輕患者身體的負擔。
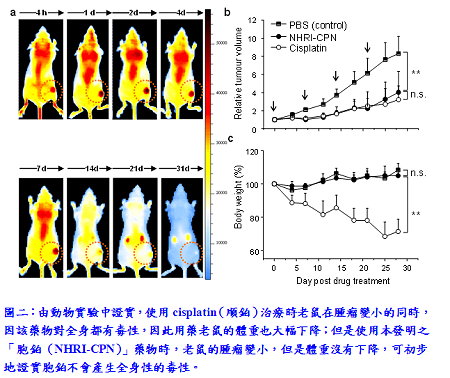 從初步的實驗結果,已知「胞鉑」,是藉由endocytosis的方式進入,並不經由離子通道:copper transporter 1(Ctr1)(「順鉑」進入細胞的途徑之一),有機會毒殺對「順鉑」產生抗藥性的癌細胞,例如:卵巢癌細胞。因為該類細胞表面的Ctr1表現量減少,所以導致在臨床治療時「順鉑」不易進入,也就是真正進入癌細胞的藥量極少,因此不易治療。「胞鉑」的優勢:不僅避開透過Ctr1吸收之抗藥性問題,更重要的是在於腫瘤細胞始活化的毒理機制,能有效降低化學療法所衍生之生理副作用。目前此新穎藥物業已尋求院內跨單位的協同合作,希望有機會挑戰難纏的肺腺癌、卵巢癌及胰臟癌,而為癌末病人帶來新契機。
從初步的實驗結果,已知「胞鉑」,是藉由endocytosis的方式進入,並不經由離子通道:copper transporter 1(Ctr1)(「順鉑」進入細胞的途徑之一),有機會毒殺對「順鉑」產生抗藥性的癌細胞,例如:卵巢癌細胞。因為該類細胞表面的Ctr1表現量減少,所以導致在臨床治療時「順鉑」不易進入,也就是真正進入癌細胞的藥量極少,因此不易治療。「胞鉑」的優勢:不僅避開透過Ctr1吸收之抗藥性問題,更重要的是在於腫瘤細胞始活化的毒理機制,能有效降低化學療法所衍生之生理副作用。目前此新穎藥物業已尋求院內跨單位的協同合作,希望有機會挑戰難纏的肺腺癌、卵巢癌及胰臟癌,而為癌末病人帶來新契機。《文/圖:生醫工程與奈米醫學研究所簡至德博士、顏佳瑩研究助理、林淑宜副研究員》