NHRI Communications

研究發展
治療急性骨髓性白血病的新標靶-FLT3抑制劑
FLT3 inhibitor as a novel target for acute myeloid leukemia treatment
 急性骨髓性白血病(acute myeloid leukemia, AML)在成年人的白血病中最為常見,是一種因骨髓中白血球細胞過度增生而導致無法正常製造紅血球的急性疾病。白血病的致因迄今不明,但醫界指出,可能與下列因素有關:男性、吸菸(尤其60歲以上之患者)、長期暴露在輻射線或放射物質下如暴露於原子彈輻射、曾經接受化學治療或兒童急性淋巴性白血病治療、長期接觸苯類化學物,此外,遺傳基因異常或免疫系統異常也是造成白血病的激發因素。台灣地區每年約有600到1,000名新增白血病病患(台灣癌症基金會統計),而美國每年約有12,000名的新增白血病病患。
急性骨髓性白血病(acute myeloid leukemia, AML)在成年人的白血病中最為常見,是一種因骨髓中白血球細胞過度增生而導致無法正常製造紅血球的急性疾病。白血病的致因迄今不明,但醫界指出,可能與下列因素有關:男性、吸菸(尤其60歲以上之患者)、長期暴露在輻射線或放射物質下如暴露於原子彈輻射、曾經接受化學治療或兒童急性淋巴性白血病治療、長期接觸苯類化學物,此外,遺傳基因異常或免疫系統異常也是造成白血病的激發因素。台灣地區每年約有600到1,000名新增白血病病患(台灣癌症基金會統計),而美國每年約有12,000名的新增白血病病患。急性骨髓性白血病的治療,以化學治療及幹細胞移植為主,可以達到20 - 60%的治癒率。在化學治療方面,由台灣癌症基金會所發表的文章顯示(馬偕紀念醫院血液腫瘤科 黃明哲/林建鴻),目前急性骨髓性白血病經化學治療後緩解率在60%之間,5年存活率約為20%,而急性前骨髓性白血病經過全反式維甲酸及化學治療後緩解率超過90%,3年存活率約為50%。當病患達到完全緩解後,如能接受骨髓移植或周邊血幹細胞移植者則有更高的存活率。近年來在急性骨髓性白血病的研究上,常發現有關於某些基因的異常突變及異常表現,使我們對於白血病的成因有了更進一步的瞭解。而這些分子基因的異常,對於急性骨髓性白血病的預後有相當重要的影響,也有機會成為分子醫療的新標靶。
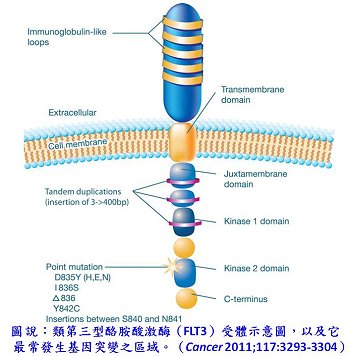
類第三型酪胺酸激酶(FMS-like tyrosine kinase 3, FLT3)是處於細胞表面的受體,在骨髓中扮演著區分造血幹細胞的重要角色,在急性骨髓性白血病的患者上發現FLT3會被過度表現及突變,活性變異的FLT3在細胞表面受體與配位體結合後,會磷酸化其分子結構而誘導之後的細胞間訊息傳遞,活性FLT3-ITD (an internal tandem duplication mutation in juxtamembrane domain)與FLT3-KDM(a mutation surrounding Asp835 residue within kinase domain)的突變在急性骨髓性白血病的患者中(30%患者)最常被發現(圖一),這些突變與接受傳統化學療法預後較差的患者上會有些關聯性,因此FLT3抑制劑極有可能發展成為治療急性骨髓性白血病的標靶藥物。
目前已有不少小分子FLT3抑制劑已進入臨床2、3期研究,但整體而言,單獨使用於急性骨髓性白血病的治療,其效果並不好。其原因在於這些FLT3抑制劑如多重標靶激酶抑制劑lestaurtinib (CEP-701)、PKC-412等因毒性較強、藥物動力學不佳且抑制FLT3-ITD之能力較差,因此無法給予較高劑量達到期望的藥效,或如ABT-869、Sutent等因藥效較差,即對於作用標靶的強度不夠,無法有效地殺死癌細胞,導致這些早期的FLT3抑制劑臨床發展藥物雖能有效減少週邊血液之異常芽細胞,但對於骨髓內異常芽細胞抑制能力有限,因此中等程度的療效而且藥效短暫與快速產生抗藥性是臨床上常觀察到的現象。
目前臨床試驗效果最好的FLT3抑制劑為專一性較高的AC220(quizartinib),此藥物已進入臨床3期試驗。相較於AC220,本院生技與藥物研究所新藥研發團隊發展的FLT3抑制劑BPR000J雖為多重標靶激酶抑制劑,但與目前在臨床試驗的多重標靶激酶抑制劑CEP-701、PKC-412不同的是,BPR000J對於FLT3-ITD細胞株(MOLM-13與MV4-11)之抑制效果優於AC220,在細胞株MV-411異種移植(xenograft model)的動物藥效實驗效果則相當。最重要的是對於在臨床上已知具有AC220抗藥性之突變細胞株如32D/ITD-D835Y、32D/ITD-D835V、32D/ITD-D835F及32D/ITD-F691L,BPR000J之抑制效果亦優於AC220約3-5倍。基於上述說明,BPR000J有機會能解決目前FLT3抑制劑在臨床應用上不足之處,在急性骨髓性白血病的治療上,提供新的解決策略。
《文:生技與藥物研究所蔣維棠研究員》