NHRI Communications

院務紀事
2014 NHRI Research Day優秀論文口頭報告、壁報論文及優秀研究助理獎勵評選活動紀實
NHRI announces recipients of Research Day Awards for Outstanding Papers, Posters, and Research Assistants
 為鼓勵本院年輕研究人員踴躍發表論文及獎勵優秀研究助理,特於3月17至18日假竹南院區辦理2014 NHRI Research Day,進行優秀論文口頭報告、壁報論文及優秀研究助理評選活動暨頒獎儀式。到職滿1年之博士後研究員及博士班4年級以上學生均應發表論文並開放自由投稿,共計投稿口頭報告10篇(含單位推薦)、壁報論文152篇,依領域分為基礎醫學、應用醫學及臨床醫學/公衛3組;而本年度獲得單位推薦參與評選之優秀研究助理共計有28名。
為鼓勵本院年輕研究人員踴躍發表論文及獎勵優秀研究助理,特於3月17至18日假竹南院區辦理2014 NHRI Research Day,進行優秀論文口頭報告、壁報論文及優秀研究助理評選活動暨頒獎儀式。到職滿1年之博士後研究員及博士班4年級以上學生均應發表論文並開放自由投稿,共計投稿口頭報告10篇(含單位推薦)、壁報論文152篇,依領域分為基礎醫學、應用醫學及臨床醫學/公衛3組;而本年度獲得單位推薦參與評選之優秀研究助理共計有28名。  評選分為(由院內研究人員組成評選委員會進行評選):
評選分為(由院內研究人員組成評選委員會進行評選):- 口頭報告組:由各單位推薦人選,推薦人數為該單位應投稿人數5%(採四捨五入至整數位計算);若單位中應投稿人數少於5 人者,則由單位自行決定是否進行推薦,並開放自由投稿,於Research Day進行英文口頭報告,競爭傑出、優選及佳作獎。
- 壁報展示組:依投稿領域進行分組,擇優取各領域前10%之優秀壁報論文,取17名(含同分者)。
- 優秀研究助理:採二階段審查,第一階段由單位推薦、第二階段於Research Day進行評選,擇優取21名。
本年度優秀論文口頭報告傑出獎及優選獎獲獎人研究內容介紹如下:
傑出獎:莊懷佳博士
 目前在免疫醫學研究中心譚澤華主任實驗室進行博士後研究。
目前在免疫醫學研究中心譚澤華主任實驗室進行博士後研究。過去的研究利用細胞株或是臨床腫瘤檢體已發現,MAP4K4(HGK)可能參與細胞活動能力或是癌細胞轉移的功能,然而,HGK在活體中真正的功能尚待研究。研究團隊利用T淋巴細胞專一性HGK基因剔除小鼠研究HGK在T淋巴細胞中扮演的角色,發現此小鼠具嚴重的全身性發炎反應,同時,在此小鼠血清中偵測到過量的發炎細胞激素。利用專一性抗體調降小鼠體內之發炎性細胞激素,或是運用細胞激素基因剔除小鼠,研究團隊證明HGK剔除的T淋巴細胞所引發之過量的發炎細胞激素,可誘發小鼠產生胰島素阻抗與第二型糖尿病。研究團隊也利用T淋巴細胞專一性之脂肪激素受體基因剔除小鼠,證實脂肪組織吸引了HGK剔除的T淋巴細胞;來自T淋巴細胞的細胞激素與來自脂肪細胞的脂肪激素,共同誘發此T淋巴細胞進一步分化成為發炎性T淋巴細胞,而最終導致脂肪細胞產生胰島素阻抗。HGK調降與第二型糖尿病之關聯也在臨床檢體中獲得證實。此研究亦揭露T淋巴細胞與脂肪細胞間的交互作用,為誘發第二型糖尿病的重要機制。
優選獎:陳莉菁同學
 目前為細胞及系統醫學研究所裘正健老師實驗室博士班學生。
目前為細胞及系統醫學研究所裘正健老師實驗室博士班學生。研究主題為探討微型核糖核酸(microRNA)在動脈硬化症發生過程中所扮演之角色。在患有動脈硬化症的人類冠狀動脈組織中發現miR-451會大量表現在血管中膜層的平滑肌細胞,為了進一步探討miR-451在平滑肌細胞所扮演之角色,研究團隊利用本實驗已建立的單層型膠原蛋白/纖維型膠原蛋白(monomeric/fibrillar collagen)的培養模式,證實miR-451藉由抑制下游標的基因Rab5a,進而抑制平滑肌細胞生長的功能。在ApoE-/- mice所誘發的動脈硬化斑中,發現miR-451只會表現在初期的動脈硬化斑中。隨著動脈硬化斑的嚴重程度增加,miR-451表現會逐漸減少,而其下游標的基因Rab5a卻隨之增加。由於文獻指出microRNA可被細胞釋放至血液循環系統中,可作為疾病診斷與治療的分子標靶。所以研究團隊進一步分析ApoE-/- mice與冠狀動脈硬化症病人血液中的circulating miR-451,研究結果發現circulating miR-451的表現在ApoE-/-mice與冠狀動脈硬化症病人顯著地低於正常mice與健康志願者。ApoE-/- mice在藉由尾靜脈注射agomiR-451大量表現miR-451三個月後,利用oil red staining分析動脈硬化斑,結果顯示經過agomiR-451處理的ApoE-/-mice其動脈硬化斑顯著地減少。研究結果顯示miR-451具有保護血管並抑制動脈硬化斑的發生,miR-451與其下游標的基因Rab5a可提供作為未來動脈硬化症治療之新方向。
優選獎:陳煌輝博士
目前在生技與藥物研究所郭靜娟老師實驗室進行博士後研究。
研究主題為新穎Nrf2活化劑誘導細胞內抗氧化與去毒酵素的表現及其細胞保護作用機制之探討。研究團隊首先成功建立細胞內Nrf2調節劑高效率篩選系統,並成功從薏仁萃取出的純化合物中篩選出高效能Nrf2活化劑--trans-coniferyl aldehyde(t-CA)。經由分析,t-CA可以誘導Nrf2蛋白的磷酸化並且抑制Nrf2蛋白降解作用,使Nrf2蛋白進入細胞核並且大量累積。在抗氧化去毒活性方面,t-CA可以誘導第二期抗氧化、去毒性酵素與第三期耗能性藥物排出蛋白等基因的表現增加,其中以HO-1最為明顯。同時測得了細胞內的GSH量明顯增加。利用小鼠模型,研究團隊亦發現t-CA可以讓肝細胞大量表現第二期抗氧化、去毒性酵素與第三期耗能性藥物排出蛋白等基因。研究發現Nrf2專一性siRNA可以抑制t-CA誘導之Nrf2蛋白的磷酸化,以及HO-1與AKR1-C1的表現,如此更加確定Nrf2在t-CA誘導之抗氧化去毒反應中扮演的角色。在細胞保護作用方面,t-CA可以減少H2O2以及檳榔鹼誘發的細胞氧化壓力,並且保護細胞中DNA受H2 O2以及檳榔鹼的破壞,進而保護細胞存活。在作用機轉方面,同時投入p38抑制劑與PKC抑制劑、或是MAPKAPK與PK-N3專一性siRNA可完全抑制t-CA誘導之Nrf2蛋白的磷酸化,以及HO-1的表現,如此確定t-CA誘導的抗氧化去毒機制是經由p38與PK-N3訊息傳遞路徑活化Nrf2蛋白的磷酸化執行。總結來說,研究結果找到一個新穎化合物,具有調控Nrf2路徑之活性,並且活化細胞內第二期抗氧化、去毒性酵素與第三期耗能性藥物排出蛋白等基因表現,進而保護細胞免於H2 O2以及致癌劑檳榔鹼的傷害。
優秀論文獲獎名單如下(依照姓氏筆畫順序排列):
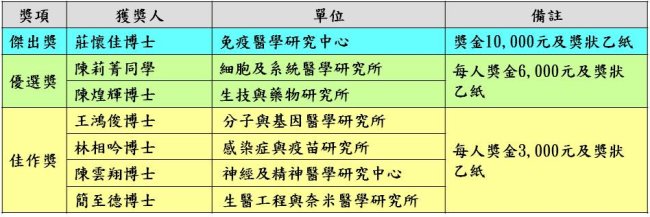
優秀壁報論文獲獎名單如下(依照姓氏筆畫順序排列):
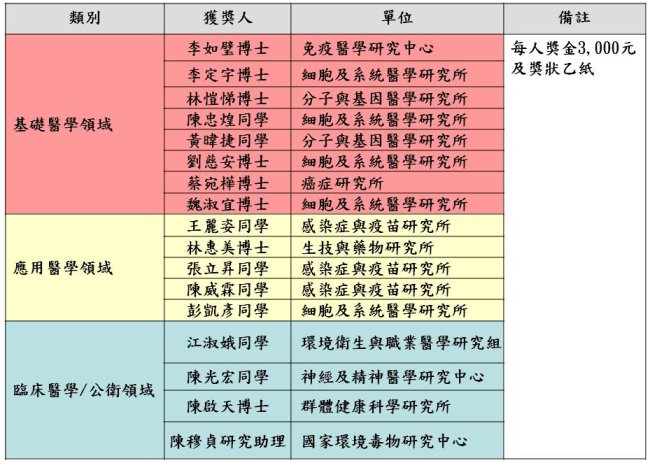
2014優秀研究助理獎勵獲獎名單如下(依照姓氏筆畫順序排列):
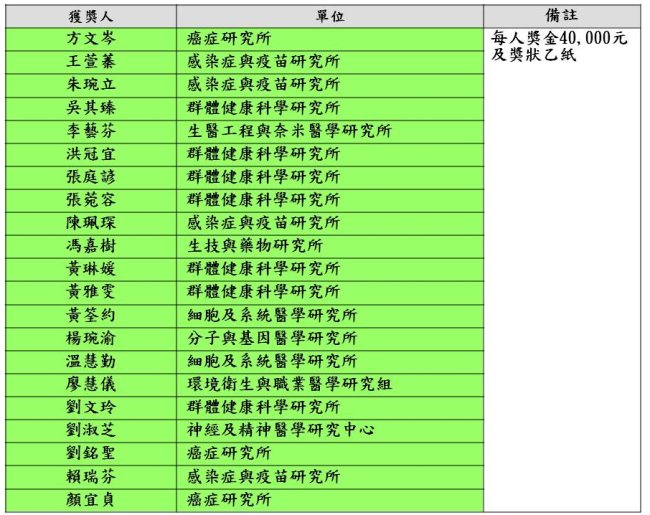
《文/圖:免疫醫學研究中心莊懷佳博士、生技與藥物研究所陳煌輝博士、細胞及系統醫學研究所陳莉菁同學提供;學術發展處蔡雨軒整理》