NHRI Communications

研究發展
血液內皮先趨細胞藉由MCP1訊息傳遞來促進miR-21新生表現而導致肝癌細胞轉移的發生
NHRI researchers discover blood-derived endothelial progenitors promote hepatocarcinoma intrahepatic metastasis through monocyte chemotactic protein-1 induction of microRNA-21
 在成人流動的血液中,數以萬計的血球不停地漫遊,近年來研究發現有一群帶有CD34/CD31/KDR/ID1等標記蛋白的內皮先趨細胞(circulating endothelial progenitor cells, cEPCs)逐漸嶄露頭角,除了參與心血管疾病的內皮修補外,進一步證實扮演著腫瘤血管新生的開關(angiogenic switch)角色。本院細胞及系統醫學研究所所長裘正健研究員所帶領的研究團隊,發現人類周邊血液中的內皮先驅細胞中之骨髓系內皮先驅細胞(myeloid-derived EPCs, CFU-ECs)會藉由分泌出高量的單核細胞趨化蛋白(monocyte chemoattractant protein-1, MCP-1),引起微小核醣核酸21型(microRNA-21, miR-21)生成,使得肝癌細胞移動性增加並導致上皮-間質轉化 (epithelial-mesenchymal transition, EMT)轉型及惡性肝內轉移(intrahepatic metatstatsis, IM)之發生,加快原發型肝癌細胞的發展與惡化轉移。此項研究已發表於腸胃病與肝疾病研究領域之優秀國際期刊Gut (IF=13.319, Ranking=2/74 in Gastroenterology & Hepatology)。
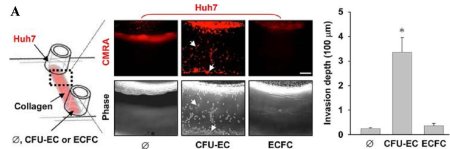
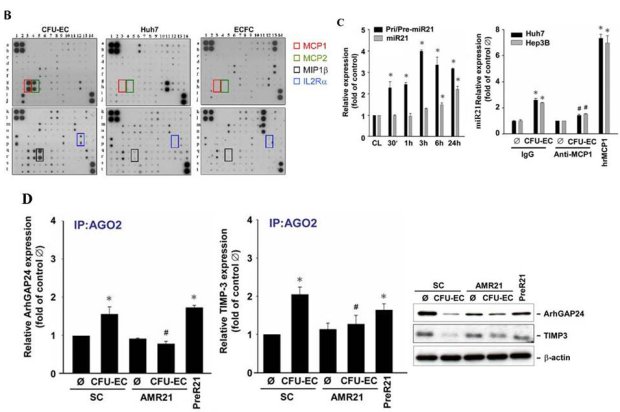
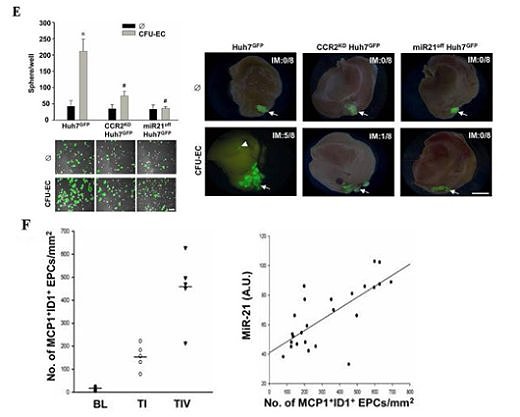
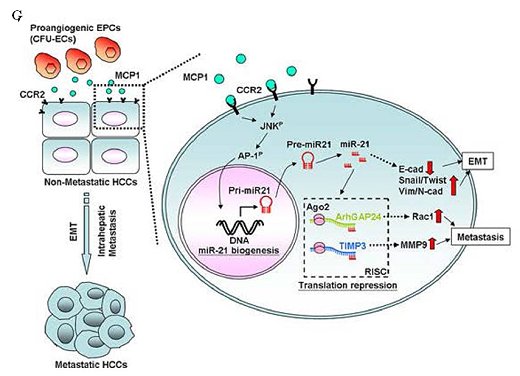
在成人流動的血液中,數以萬計的血球不停地漫遊,近年來研究發現有一群帶有CD34/CD31/KDR/ID1等標記蛋白的內皮先趨細胞(circulating endothelial progenitor cells, cEPCs)逐漸嶄露頭角,除了參與心血管疾病的內皮修補外,進一步證實扮演著腫瘤血管新生的開關(angiogenic switch)角色。本院細胞及系統醫學研究所所長裘正健研究員所帶領的研究團隊,發現人類周邊血液中的內皮先驅細胞中之骨髓系內皮先驅細胞(myeloid-derived EPCs, CFU-ECs)會藉由分泌出高量的單核細胞趨化蛋白(monocyte chemoattractant protein-1, MCP-1),引起微小核醣核酸21型(microRNA-21, miR-21)生成,使得肝癌細胞移動性增加並導致上皮-間質轉化 (epithelial-mesenchymal transition, EMT)轉型及惡性肝內轉移(intrahepatic metatstatsis, IM)之發生,加快原發型肝癌細胞的發展與惡化轉移。此項研究已發表於腸胃病與肝疾病研究領域之優秀國際期刊Gut (IF=13.319, Ranking=2/74 in Gastroenterology & Hepatology)。 相關臨床肝癌研究指出,周邊血液或骨髓液內的內皮先驅細胞的招募(recruitment)數目會隨著肝癌病程惡化而增加,而此類細胞已知具有促進血管新生的能力,參與肝癌血管新生的發生,但是內皮先驅細胞對於癌症細胞的相關分子機制與癌細胞轉移效應仍未明瞭。此研究藉由分離出兩種人類周邊血內的內皮先驅細胞:骨髓系內皮先驅細胞(CFU-ECs)與衍生型內皮先驅細胞(ECFCs),分別與原發型肝癌細胞株(Huh7 and Hep3B cells)建立共同培養系統,發現只有CFU-ECs能夠明顯誘發肝癌細胞移動(migration)與侵入(invasion)(圖A);進一步,利用蛋白質晶片(protein array)技術,發現CFU-ECs會藉由分泌出MCP-1(圖B)活化肝癌細胞內CCR2/JNK/AP1訊息傳遞路徑,直接誘發肝癌細胞miR-21之新生表現(biogenesis)(圖C),並且miR-21直接調控ArhGAP24與TIMP3等相關抑制細胞移動性之蛋白質表現(圖D),引起癌細胞活化GTPase蛋白Rac1與基質金屬蛋白酶MMP9,最終導致肝癌細胞發生上皮-間質轉化(EMT),增加肝癌細胞侵入性能力及惡性肝內轉移(IM)之機率(圖E)。不僅如此,在臨床患有肝癌的病人檢體中,表現MCP-1的ID1+EPCs數目與肝癌細胞miR-21表現量、肝癌轉移能力與其分期(TNM stage I and IV)均呈現正向關聯性(圖F),顯示來自血液衍生出的內皮先驅細胞除了能參與血管新生之作用外,並且能藉由胞外分泌出MCP-1誘發鄰近的肝癌細胞表現出miR-21,增加癌症惡性轉移之發生率(圖G)。
目前關於EPCs的臨床應用,除了開始利用EPCs成為新的肝癌細胞標靶之外(將體外培養出自體周邊血EPCs作為細胞載體攜帶抗癌藥物去攻擊自身肝癌細胞),本研究結果提供了以下臨床上的醫療新方向:(1)EPCs被認可將成為新的血清特殊標記(seromarker),可用於評估肝癌與慢性肝癌之相關病程與其預後狀況;(2)臨床上可運用干擾EPCs對於肝癌血管新生及轉移能力的相關分子機制(例如:targeting MCP-1/CCR2 訊息路徑與miR-21的合成),研發出干擾血管新生與惡性轉移相關之抗癌新策略。
《文/圖:細胞及系統醫學研究所施佑宗博士、王美存研究助理;指導研究員:裘正健研究員》