NHRI Communications

研究發展
抑制對基利克具抗藥性的胃腸道基質瘤中的mTOR可加速由NVP‐AUY922所誘發經由自噬作用所調控之KIT蛋白質的降解與細胞毒殺
MTOR inhibition enhances NVP‐AUY922‐induced autophagy‐mediated KIT degradation and cytotoxicity in imatinib‐resistant gastrointestinal stromal tumors
 胃腸道基質瘤(gastrointestinal stromal tumors)的病患中,約有80%是因為KIT基因突變而致使細胞癌化。目前基立克(Gleevec®; imatinib mesylate, IM)為治療轉移性或無法切除之胃腸道基質瘤的一線藥物。然而,在持續的用藥過程中,胃腸道基質瘤之KIT基因可產生繼發性突變,導致IM抗藥性的發生。第二線藥物舒癌特(Sutent®; sunitinib malate, SU)與第三線藥物Stivarga®(regorafenib)相繼上市,而針對KIT酪氨酸激(tyrosine kinase inhibitor)抗藥性的問題日漸嚴重,相關研究正積極投入以尋求新型替代性療法。在前期研究中,研究團隊使用新一類熱休克蛋白90抑制劑(HSP90 inhibitor)NVP‐AUY922(AUY922),探討其用於治療對IM或SU有抗藥性之胃腸道基質瘤病人的可行性,以及相關的作用機轉。總結來說,此研究成果為第一個證實自噬作用參與在KIT內生性循環與AUY922所造成之蛋白質降解,同時,在細胞實驗中,也證明AUY922用於治療有KIT表現且對IM/SU具抗藥性之胃腸道基質瘤的可行性;此研究成果於2013年發表於Autophagy(IF: 11.423, Ranking: 12/185)期刊中。然而在AUY922的第一期臨床試驗中卻發現,AUY922會造成劑量依存(dose‐dependent)的視網膜病變,若能降低藥物劑量或許可改善此副作用的症狀與發生率。
胃腸道基質瘤(gastrointestinal stromal tumors)的病患中,約有80%是因為KIT基因突變而致使細胞癌化。目前基立克(Gleevec®; imatinib mesylate, IM)為治療轉移性或無法切除之胃腸道基質瘤的一線藥物。然而,在持續的用藥過程中,胃腸道基質瘤之KIT基因可產生繼發性突變,導致IM抗藥性的發生。第二線藥物舒癌特(Sutent®; sunitinib malate, SU)與第三線藥物Stivarga®(regorafenib)相繼上市,而針對KIT酪氨酸激(tyrosine kinase inhibitor)抗藥性的問題日漸嚴重,相關研究正積極投入以尋求新型替代性療法。在前期研究中,研究團隊使用新一類熱休克蛋白90抑制劑(HSP90 inhibitor)NVP‐AUY922(AUY922),探討其用於治療對IM或SU有抗藥性之胃腸道基質瘤病人的可行性,以及相關的作用機轉。總結來說,此研究成果為第一個證實自噬作用參與在KIT內生性循環與AUY922所造成之蛋白質降解,同時,在細胞實驗中,也證明AUY922用於治療有KIT表現且對IM/SU具抗藥性之胃腸道基質瘤的可行性;此研究成果於2013年發表於Autophagy(IF: 11.423, Ranking: 12/185)期刊中。然而在AUY922的第一期臨床試驗中卻發現,AUY922會造成劑量依存(dose‐dependent)的視網膜病變,若能降低藥物劑量或許可改善此副作用的症狀與發生率。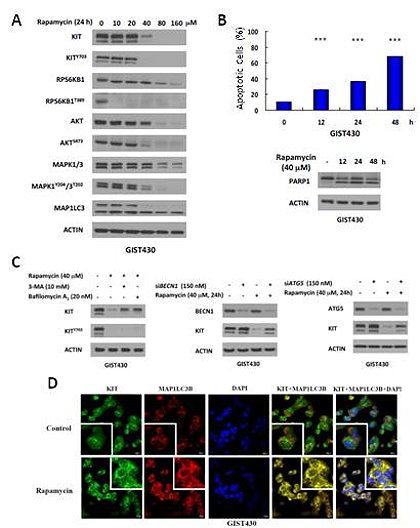 因此,基於先期研究成果,本研究嘗試以AUY922與其他自噬作用誘發物(autophagy inducer),如斥消靈(Rapamune®; Sirolimus, rapamycin),在胃腸道基質瘤上合併使用的效果。結果顯示,自噬作用誘發物rapamycin確實可造成在對IM具抗藥性的胃腸道基質瘤細胞株GIST48與GIST430中,突變KIT蛋白質磷酸化程度與表現量的減少、細胞凋亡的比例增加(圖A和B),進而導致癌細胞的減少。此一現象,也經由自噬作用抑制劑、干擾autophagsome形成之必要蛋白質BECN1或ATG5生成、KIT蛋白質與MAP1LC3B或SQSTM1所標記的autophagosome共位現象等實驗(圖C和D),證實rapamycin引起KIT蛋白質的降解是經由自噬作用的活化所造成。進一步的研究結果顯示,相較於單獨使用,AUY922與rapamycin的合併使用可更有效地造成KIT蛋白質降解、癌細胞的凋亡與生長抑制(圖E)。
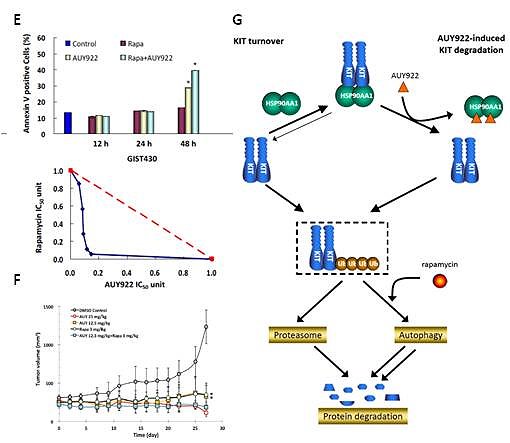
因此,基於先期研究成果,本研究嘗試以AUY922與其他自噬作用誘發物(autophagy inducer),如斥消靈(Rapamune®; Sirolimus, rapamycin),在胃腸道基質瘤上合併使用的效果。結果顯示,自噬作用誘發物rapamycin確實可造成在對IM具抗藥性的胃腸道基質瘤細胞株GIST48與GIST430中,突變KIT蛋白質磷酸化程度與表現量的減少、細胞凋亡的比例增加(圖A和B),進而導致癌細胞的減少。此一現象,也經由自噬作用抑制劑、干擾autophagsome形成之必要蛋白質BECN1或ATG5生成、KIT蛋白質與MAP1LC3B或SQSTM1所標記的autophagosome共位現象等實驗(圖C和D),證實rapamycin引起KIT蛋白質的降解是經由自噬作用的活化所造成。進一步的研究結果顯示,相較於單獨使用,AUY922與rapamycin的合併使用可更有效地造成KIT蛋白質降解、癌細胞的凋亡與生長抑制(圖E)。此外,在GIST430的動物實驗中,相較於個別藥物使用,低濃度AUY922與rapamycin合併使用可更顯著地造成腫瘤體積的縮小(圖F)、減少KIT蛋白質的表現量,以及自噬作用的活化,且與高濃度AUY922單獨使用達到同等程度的治療效果。綜合目前結果,研究團隊證明在細胞與動物實驗中,AUY922用於治療具有KIT表現且對IM/SU具抗藥性之胃腸道基質瘤的可行性;此外,低濃度AUY922與自噬作用誘發物rapamycin的合併使用可達到更佳的腫瘤抑制與毒殺的效果(圖G)。此研究成果於2014年發表於Oncotarget(IF: 6.627, Ranking: 17/202)期刊。
 依先期成果,本院癌症研究所所長陳立宗醫師(本研究主持人)已向瑞士諾華藥廠(Novartis, Switzerland)申請進行AUY9222對於IM/SU具有抗藥性之胃腸道基質瘤病人的二期臨床試驗,並通過審核,目前由台灣癌症臨床研究合作組織收案中。期望能提供對於IM/SU具有抗藥性的病人新型的替代性療法。薛元碩博士後研究員也以此研究榮獲科技部「103年度博士後研究人員學術著作獎」。
依先期成果,本院癌症研究所所長陳立宗醫師(本研究主持人)已向瑞士諾華藥廠(Novartis, Switzerland)申請進行AUY9222對於IM/SU具有抗藥性之胃腸道基質瘤病人的二期臨床試驗,並通過審核,目前由台灣癌症臨床研究合作組織收案中。期望能提供對於IM/SU具有抗藥性的病人新型的替代性療法。薛元碩博士後研究員也以此研究榮獲科技部「103年度博士後研究人員學術著作獎」。《文/圖:癌症研究所陳立宗特聘研究員兼所長、薛元碩博士後研究員》