NHRI Communications

知識產權
新藥大放異彩-漫談2014年FDA核准小分子新藥(上)
Introduction to FDA approved novel small molecular drugs in 2014
 「Approvals of new chemical and biologic entities surged again in 2014, shepherded along by a confident FDA, as industry reaped the rewards of drug development incentives」此註解道出了2014年生技醫藥產業於新藥研發的歡喜豐收「註1」。2014年可謂是自1996年以來獲准新藥數目最多的一年,包括30個小分子藥物和11個生物藥等共41個新藥的豐收年,此結果不僅有利相關產業的成長,亦顯示美國食品藥物管理局(FDA)在審查效能與態度上的提升。
「Approvals of new chemical and biologic entities surged again in 2014, shepherded along by a confident FDA, as industry reaped the rewards of drug development incentives」此註解道出了2014年生技醫藥產業於新藥研發的歡喜豐收「註1」。2014年可謂是自1996年以來獲准新藥數目最多的一年,包括30個小分子藥物和11個生物藥等共41個新藥的豐收年,此結果不僅有利相關產業的成長,亦顯示美國食品藥物管理局(FDA)在審查效能與態度上的提升。2014年所核准的41個新藥中,有17個為具新穎機制市場首見(first-in-class)的新藥,值得注意的是,亦有17個(41%)是用於罕見疾病的治療,較2013年的9個、2012年的13個與2011年的11個皆有所提升;於大分子方面(抗體、胜肽和酶)亦呈現快速的成長,占所有核准藥物的四分之一。當然,這些突破性的進展均有賴于FDA新的快速審查機制,其中尤以突破性治療(breakthrough therapy)最為代表,一共有9個突破性藥物被核准;此外,有8個新藥是循加速核准(accelerated approval)機制獲得藥物許可證,其中7個為抗癌藥物,顯示此機制於其他治療領域尚未發揮應有的效應,但由此可預知未來循此機制獲得核准的藥物將會大幅成長「註2、註3」。
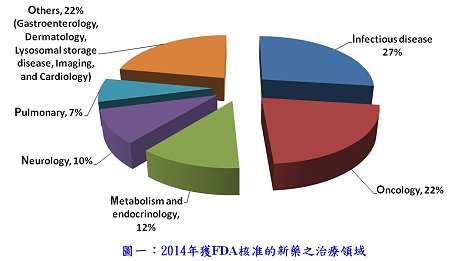
2014年獲FDA核准的新藥橫跨10個治療領域(如圖一所示),以癌症藥物與感染性疾病藥物為主。2014年共核准8個癌症治療藥物與1個癌症化療止吐藥(22%),相較於2012年(9個,33%)與2013年(13個,33%),並無特別的表現,反倒是感染性疾病用藥由2013年的3個(11%)增加到2014年的11個,占所有核准新藥的27%,其中有4個是被授予合格感染性疾病產品資格(qualified infectious disease product, QIDP)而獲得FDA核准的抗生素「註3」。
本報導將分上下兩期回顧2014年獲FDA核准的小分子藥物,首先介紹的是抗癌藥物、抗C型肝炎藥物和抗糖尿病藥物。
抗癌藥物
2014年共有8個癌症治療新藥上市,約占所有核准藥物的五分之一。其中4個是單株抗體 (Opdivo® 、Keytruda® 、BlincytoTM、Cyramza® ),另4個是小分子藥物,包括2個市場首見新藥(first-in-class)-LynparzaTM 和Zydelig®與2個類新藥(me-too)-ZykadiaTM 和 Beleodaq®。
(1) LynparzaTM(olaparib)
 在2014年12月19日,英國阿斯特捷利康公司(AstraZeneca)之LynparzaTM (Olaparib, AZD-2281, KU 59436)是第一個以聚ADP-核糖聚合酶(poly ADP ribose polymerase, PARP)為藥物標靶,獲得FDA以加速核准機制同意上市的藥物,用以治療與BRCA基因突變(gBRCAm)相關的晚期卵巢癌,該基因突變可由FDA批准的診斷試劑進行檢測 (BRACAnalysis CDx, 由Myriad Genetics公司生產)。
在2014年12月19日,英國阿斯特捷利康公司(AstraZeneca)之LynparzaTM (Olaparib, AZD-2281, KU 59436)是第一個以聚ADP-核糖聚合酶(poly ADP ribose polymerase, PARP)為藥物標靶,獲得FDA以加速核准機制同意上市的藥物,用以治療與BRCA基因突變(gBRCAm)相關的晚期卵巢癌,該基因突變可由FDA批准的診斷試劑進行檢測 (BRACAnalysis CDx, 由Myriad Genetics公司生產)。LynparzaTM最早是由研發DNA修復的英國生技公司KuDOS Pharmaceuticals研發,由於在臨床I期優異的成果,於2005年12月23日被AstraZeneca以2億1 千萬美元併購,後經過 9年的時間,此PARP抑制劑才得以順利上市。此藥物開發過程並不順利,主要的挫折在於2011年12月的臨床II期期中分析發現,無病變存活期(progression-free survival, PFS)之效益無法轉譯整體存活(overall survival, OS)效益。儘管AstraZeneca已花費2億8,500萬美元,亦斷然停止所有相關臨床試驗,直到2013年4月才特別針對BRCA基因突變晚期卵巢癌婦女,進行臨床III期試驗。在經過LynparzaTM藥物治療的137位帶有gBRCAm的患者中,有34%的受試者獲得平均7.9個月的症狀反應(objective response rate)。值得一提的是,BRCA檢測需要花費4,040美元,雖然LynparzaTM的治療費用並未公布,但AstraZeneca公司預估LynparzaTM 將會為藥廠帶來一年20億美元收益,顯示此藥物未來定價將不便宜。
(2) Zydelig®(idelalisib)
 在2014年7月23日,美國吉利德科學公司(Gilead Sciences)所開發的第一個口服、具選擇性的磷酸肌醇3-激酶delta(PI3K-delta, P110-delta)抑制劑Zydelig®(delalisib, GS-1101, CAL-101)獲得FDA以加速核准機制同意上市。Zydelig®在臨床上是用於復發性濾泡B細胞非霍奇金淋巴瘤(follicular B-cell non-Hodgkin lymphoma, FL)和復發性小淋巴細胞淋巴瘤(small lymphocytic lymphoma, SLL)的治療。FDA加速批准Zydelig®是基於123位受試者接受Zydelig® 藥物治療後,分別有54% FL受試者和58% SLL受試者達到症狀反應。
在2014年7月23日,美國吉利德科學公司(Gilead Sciences)所開發的第一個口服、具選擇性的磷酸肌醇3-激酶delta(PI3K-delta, P110-delta)抑制劑Zydelig®(delalisib, GS-1101, CAL-101)獲得FDA以加速核准機制同意上市。Zydelig®在臨床上是用於復發性濾泡B細胞非霍奇金淋巴瘤(follicular B-cell non-Hodgkin lymphoma, FL)和復發性小淋巴細胞淋巴瘤(small lymphocytic lymphoma, SLL)的治療。FDA加速批准Zydelig®是基於123位受試者接受Zydelig® 藥物治療後,分別有54% FL受試者和58% SLL受試者達到症狀反應。另外,Zydelig®和Rituxan®(rituximab)共同使用亦可治療復發性慢性淋巴細胞白血病(chronic lymphocytic leukemia, CLL)。Zydelig®是FDA第5個通過突破性治療(BT)認證之藥物,亦是此認證下第3個通過治療CLL之藥物(先前有Gazyva®(obinutuzumab,2013年11月)和 Arzerra®(ofatumumab,2014年4月)是以此BT認證通過治療CLL疾病)。Zydelig® 雖是一個激酶抑制劑,但不直接抑制腫瘤的生長,而是透過調節免疫系統發揮作用。也就是說,P110-delta參與改變B淋巴細胞的免疫環境,對於腫瘤細胞的活化、增殖、生存和轉移具有關鍵作用,故於Imbruvica®(ibrutinib)之外,為CLL患者帶來另一個新的選擇。
Zydelig® 一樣也是大藥廠透過併購生技公司而取得的藥物。在2011年2月22日Gilead Sciences以3億7,500萬美元買下位於美國西雅圖的Calistoga Pharmaceuticals公司,外加2億2,500萬美元作為里程碑金。目前Gilead Sciences將Zydelig®藥價訂為7,200美元/月,主要原因是要低於競爭對手Imbruvica®的 8,200美元/月的價格。但若與Rituxan®合併使用,一個月藥價會高達12,000美元,預估全年銷售金額到2017年將達到15億美元。
(3) ZykadiaTM(ceritinib)
肺腺癌激酶標靶藥物治療,自Iressa®(gefitinib)和Tarceva®(erlotinib)針對EGFR基因變異上市後,開啟肺腺癌個體化治療之濫觴「註4」。爾後在2013年7月由百靈佳殷格翰公司(Boehringer Ingelheim)開發的第二代EGFR抑制劑Gilotrif®(afatinib)獲得FDA核准上市。由於基因變異在肺腺癌治療上扮演非常重要的角色,因此當日本自治醫科大學(Jichi Medical University)真野廣之(Hiroyuki Mano)團隊在2008年發現在2至7%非小細胞肺癌(non-small cell lung cancer, NSCLC)患者,有echinoderm microtubule-associated protein-like-4 (EML4)-Anaplastic lymphoma kinase gene (ALK) 融合基因時,輝瑞藥廠(Pfizer)隨即進行藥物研發,並在2011年9月26日以第一個針對間變性淋巴瘤激酶(ALK)抑制劑Xalkori®(crizotinib)在第I期臨床試驗的優異療效,獲得FDA以突破性治療認證和加速核准機制同意上市「註5」。
在2014年4月29日,FDA以突破性治療認證批准由諾華藥廠(Novartis)開發的第二代ALK抑制劑ZykadiaTM(ceritinib, LDK378)上市。 ZykadiaTM可以克服因Xalkori® 治療所產生的抗藥性突變(L1196M、G1269M、I1171T和S1206Y),故適用於之前接受過Xalkori®治療的轉移性ALK陽性NSCLC患者。FDA新聞稿指出,ZykadiaTM是第4個以突破性治療認證藥物,再加上加速核准機制,比一般正常審查提早4個月核准。163位帶有ALK-陽性轉移性NSCLC患者,以ZykadiaTM治療後,有54.6%的受試者達症狀反應,平均維持7.4個月。
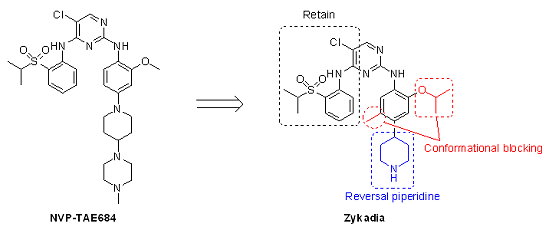
其實ZykadiaTM並不是Novartis開發的第一個ALK抑制劑,早在2007年Novartis團隊即在Proceedings of the National Academy of Sciences of the United States of America 期刊揭露NVP-TAE684為高活性和高選擇性的ALK抑制劑,但由於NVP-TAE684的代謝產物會與抗氧化劑—穀胺甘肽(glutathione, GSH)結合,故Novartis並沒有繼續發展NVP-TAE684,但依據NVP-TAE684的結構進行化學修飾,利用兩官能基(甲基與異丙基)產生立體障礙,並將piperidine反轉(reversal),以避免會與GSH結合的1,4-diiminoquinone之形成,最後設計出ZykadiaTM,具有相當不錯的ALK抑制活性(IC50 = 0.2 nM),隨後在2011年1月正式進行臨床試驗,以不到3年半的時間,順利取得上市。
由於ZykadiaTM 是可以克服因 Xalkori® 治療產生的抗藥性之第二代藥物,1天僅需服用1次(750 mg),目前藥價為13,200美元/月,比起第一線ALK藥物Xalkori® ,1天服用2次(250 mg x 2),還要貴1,700美元(Xalkori®藥價為11,500美元/月);分析師預估:到 2018年ZykadiaTM能達到4.23億美元銷售金額。目前至少還有8個ALK藥物在進行臨床試驗,包括alectinib、AP26113、ASP3026、TSR-011、PF-06463922、RXDX-101 (NMS-E628)、CEP-37440和X-396。其中羅氏藥廠與中外製藥(Roche/Chugai)alectinib來勢洶洶,去年7月3日已獲得在日本上市,目前正在美國進行臨床III期試驗。
(4) Beleodaq® (belinostat)
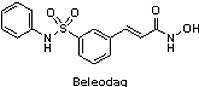 繼2006年的Zolinza® (vorinostat, SAHA)和2009年的Istodax®(romidepsin, FK228, FR901228)之後,2014年7月3日FDA核准另一個由位於美國加州的Spectrum公司開發的Beleodaq®(belinostat, PXD101)注射劑用以治療皮膚T細胞淋巴瘤(cutaneous T-cell lymphoma, CTCL),此藥物為第3個獲得FDA加速核准機制和罕見藥物認證核准上市的組織蛋白去乙醯酶抑制劑(histone deacetylase, HDAC)。Beleodaq®是自2009年以來,第3個被核准用於治療罕見的侵襲性非霍奇金淋巴瘤(Non-Hodgkin lymphoma, NHL)-外週T細胞淋巴瘤(peripheral T-cell lymphoma, PTCL)。129位的復發PTCL患者,有25.8%患者經過 Beleodaq® 治療後,腫瘤消失或縮小。
繼2006年的Zolinza® (vorinostat, SAHA)和2009年的Istodax®(romidepsin, FK228, FR901228)之後,2014年7月3日FDA核准另一個由位於美國加州的Spectrum公司開發的Beleodaq®(belinostat, PXD101)注射劑用以治療皮膚T細胞淋巴瘤(cutaneous T-cell lymphoma, CTCL),此藥物為第3個獲得FDA加速核准機制和罕見藥物認證核准上市的組織蛋白去乙醯酶抑制劑(histone deacetylase, HDAC)。Beleodaq®是自2009年以來,第3個被核准用於治療罕見的侵襲性非霍奇金淋巴瘤(Non-Hodgkin lymphoma, NHL)-外週T細胞淋巴瘤(peripheral T-cell lymphoma, PTCL)。129位的復發PTCL患者,有25.8%患者經過 Beleodaq® 治療後,腫瘤消失或縮小。 Beleodaq®最早是由丹麥的生技公司 Topotarget 所開發,並於2010年3月2日以3.5億美元技轉給 Spectrum 公司。隨著Beleodaq®上市,Topotarget獲得0.25億美元現金、兩位數的權利金,以及總淨銷售額之里程碑金。之後,Topotarget 於2014年4月16日與法國 BioAlliance Pharma公司合併,改名為Onxeo,其定位為罕見癌症藥物的專門公司。
Beleodaq®目前一瓶售價為1,523.10美元,一個療程需要花費約36,000美元,分析師預估全年銷售金額到2018年將達到0.51億美元。
抗C型肝炎藥物
有別於傳統C型肝炎的治療方法-干擾素(interferon)合併抗病毒藥物Rebetol®(Ribavirin),FDA於2014年核准上市的2個可治癒C型肝炎之口服雞尾酒複方藥物,分別是Gilead Sciences的Harvoni®與艾伯維公司(AbbVie)的Viekira PakTM,二者均不需要合併干擾素即可用於第1型(genotype 1)C型肝炎的治療「註6」。
(1) Harvoni® (ledipasvir/sofosbuvir)
C型肝炎的傳統療法是藉由提高患者的免疫能力以抑制C型肝炎病毒,但是患者常有貧血、發燒、噁心及食慾不振等不適現象,且僅有約40% 的第1型患者(約占所有C型肝炎患者的70%,台灣以基因亞型1b的感染最為廣泛,約50-70%)對此療法具持續性病毒學反應(sustained virologic response),因此當與傳統療法合併使用可有效地提高第1型C型肝炎患者的治癒率達75%以上的NS3/4A蛋白酶抑制劑Victrelis®(boceprevir, Merck)和Incivek®(telaprevir, Vertex Pharmaceuticals)一經核准(2011年)即備受矚目;不過,其市場價值在Gilead Sciences於2013年推出嶄新NS5B核苷酸聚合酶抑制劑Sovaldi®(sofosbuvir)後,即快速萎縮。Sovaldi®並非Gilead Sciences的原創新藥,而是於2012年以110億美元收購Pharmasset所獲得,它不僅是第一個不需要合併干擾素即能有效治癒慢性C型肝炎的藥品(於第1型C型肝炎的治療仍須合併干擾素),更因其具高持續性病毒學反應(>90%)而創造了史無前例的銷售業績(上市後前3個月達22.7億美元),2014年還獲得了有藥界諾貝爾獎之稱的「美國蓋倫獎(Prix Galien USA Award)」。然而,Sovaldi®的高售價(單顆售價為1,000美元,12週療程要價84,000美元)與因國家不同而有的天南地北訂價(印度等91個開發中國家12週療程僅要價900美元)卻也使其備受爭議。
2014年10月10日獲FDA核准的Harvoni®即是Gilead Sciences結合與sofosbuvir抑制NS5B蛋白具互補的NS5A蛋白抑制機制所發展而成。臨床實驗結果顯示,每天服用一顆Harvoni®(90 mg sofosbuvir / 400 mg ledipasvir),經8至12週治療,對C型肝炎的治癒率高於94至99%,療效媲美Sovaldi®,且具有無需合併干擾素或Rebetol®使用的優點,使Harvoni®一躍成為治癒C型肝炎的新標竿。然而,Harvoni®的高藥價(8週/12週療程需63,000美元/94,500美元)依然是令人爭相撻伐的目標,其年銷售額預估將突破100億美元。
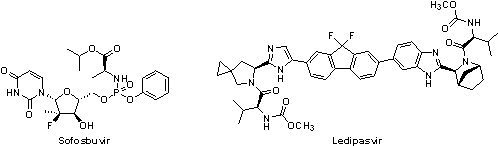
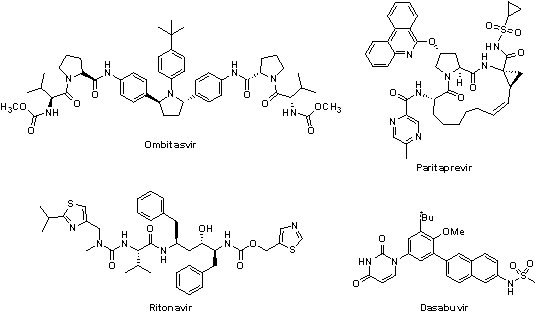
(2) Viekira PakTM(ombitasvir/paritaprevir/ritonavir with dasabuvir)
2014年12月19日AbbVie公司的Viekira PakTM獲FDA核准上市。Viekira PakTM是由3種新藥-ombitasvir(NS5A蛋白抑制劑)、paritaprevir(NS3/4A蛋白酶抑制劑)和dasabuvir(NS5B非核苷酸聚合酶抑制劑)加上原用於治療人類免疫不全病毒(HIV)的ritonavir(Norvir® ,paritaprevir代謝抑制劑)之複方,可以與或不與Rebetol®一起使用。Viekira PakTM的6個III期臨床試驗的結果顯示,95至100%的C型肝炎患者達高持續性病毒學反應,且超過98%的患者完成整個療程,因此,Viekira PakTM獲得FDA以突破性治療藥物資格審查並核准上市。
Viekira PakTM的建議劑量是每天2顆ombitasvir/paritaprevir/ritonavir(12.5 mg/75 mg/50 mg,早餐服用)和2顆250 mg的dasabuvir (早餐與晚餐各服用一顆),相較於Harvoni®,Viekira PakTM的服用方式較不方便;不過,Viekira PakTM 的12週療程比Harvoni®便宜些許,要價88,319美元,此外,全美最大的藥物供應管理商Express Scripts表示將擴大採用Viekira PakTM,因此C型肝炎患者或許可以更優惠的價格得到治療。
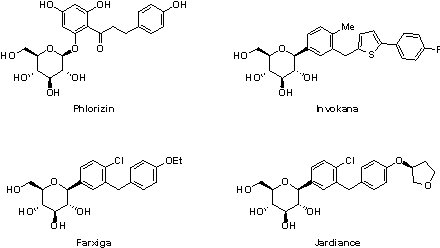
抗糖尿病藥物
2014年獲FDA核准上市的2個糖尿病口服藥物皆為SGLT2(sodium-dependent glucose co-transporter 2)抑制劑-Farxiga®(dapagliflozin. Bristol-Myers Squibb/AstraZeneca)和Jardiance®(empagliflozin,Boehringer Ingelheim/ Eli Lilly),其藉由抑制腎臟對葡萄糖的回收,從而增加尿液中葡萄糖的排出量,以達到降低血糖的作用。此類藥物的作用機轉因與胰島素的分泌無關,因此較無低血糖的問題,再者,因將患者身體過多的糖份排出,故除降血糖的功用外,亦有減少體重的附加優點,只是須注意因尿中含糖量增加所引起的感染風險「註7」。然而,FDA於2015年5月15日發布警告,稱使用SGLT2抑制劑可能會導致酮酸中毒(ketoacidosis),此為病理性代謝狀態,起因於當糖尿病患者無法利用葡萄糖時,體內脂肪與肌肉便會大量分解以作為能量來源,此時會導致副產物酮體(ketone)的大量製造,嚴重時需住院治療。據FDA統計,共有20例使用SGLT2抑制劑的患者確診為糖尿病酮酸中毒(diabetic ketoacidosis, DKA)或酮酸中毒,且均需要住院治療。FDA仍繼續在收集與SGLT2抑制劑治療相關的酮酸中毒不良反應報告,以判斷此類藥物的安全性,並建議醫師當服用SGLT2抑制劑的糖尿病患者出現與酮酸中毒類似症狀時,可評估是否為此代謝異常所引起,以適時採取適當的治療措施。
(1) Farxiga® (dapagliflozin)
源自於天然物phlorizin,已上市之SGLT2抑制劑均為葡萄糖苷類化合物,結構非常相似,其中,Invokana®(canagliflozin , Janssen Pharmaceuticals)是第一個獲FDA核准上市的SGLT2抑制劑(2013年3月),然而在此之前,Farxiga®已率先於2012年通過歐盟EMA審查,卻因膀胱癌與乳腺癌之可能風險,喪失了於美國第一上市的機會(FDA 於2012年1月拒絕了 Farxiga® 的申請),也因此當Farxiga®於2014年1月8日獲FDA核准上市時,被要求需長期追蹤服用Farxiga®的患者,以釐清Farxiga®是否與心血管風險及惡性腫瘤有直接關係。
16個臨床試驗共超過9,400位患有第二型糖尿病受試者的結果指出,Farxiga®單獨使用或與其他糖尿病用藥(metformin、pioglitazone、glimepiride、sitagliptin或胰島素)合併使用均可有效降低患者的糖化血紅素(HbA1C),其建議起始劑量為每日1次5 mg,早上空腹或用餐後使用,視必要性可增加至每日1次10 mg。
AstraZeneca公司於2014年2月3日宣布,已支付21億美元收購百時美施貴寶公司(Bristol-Myers Squibb)在全球糖尿病聯盟中的全部股份,並同意支付14億美元用以監管、上市和銷售付款,以及各種銷售相關的特許權使用費至2025年,其中6億美元為 Farxiga®在美國上市後的一切相關費用。
(2) Jardiance® (empagliflozin)
2014年8月1日 Jardiance® 成為第3個獲FDA批准上市的SGLT2抑制劑。Jardiance® 向FDA申請新藥核准的過程並不順利,主要是因為生產Jardiance® 的工廠出現顆粒汙染的問題,因此當Boehringer Ingelheim和禮來(Eli Lilly)公司於2014年3月提交新藥申請時,旋即遭到FDA拒絕,直到2014年6月FDA 確認 Jardiance® 生產工廠的管理與系統後,才又重新向FDA提交申請。
III期臨床試驗結果顯示,Jardiance® 單獨使用或與其他糖尿病用藥(metformin、sulfonylurea或胰島素)合併使用,可有效降低患者的糖化血紅素、體重與血壓。值得一提的是,2015年2月2日 FDA 批准了 Jardiance® 和Tradjenta®(linagliptin, DPP-4 inhibitor, Eli Lilly)組成的複方藥物 Glyxambi®(first-in-class),此為一日一次的口服片劑,有10 mg empagliflozin / 5 mg linagliptin 和 25 mg empagliflozin / 5 mg linagliptin 2種劑型,此複方藥物較2種藥物單獨使用時更能有效地降低患者的糖化血紅素。
註1:Morrison, C. Fresh from the biotech pipeline-2014. Nature Biotechnology . 2015, 33, 125-128.
註2:Jarvis, L. M. The year in new drugs. Chemical & Engineering News. February 2, 2015, 11-16.
註3:Mullard A. 2014 FDA drug approvals. Nature Reviews Drug Discovery. 2015, 14, 77-81.
註4:Lee, C. C.; Shiao, H. Y.; Wang, W. C.; Hsieh, H. P. Small-molecule EGFR Tyrosine Kinase Inhibitors for the Treatment of Cancer. Expert Opinion on Investigational Drugs . 2014, 23, 1333-1348.
註5:Wang, W. C.; Shiao, H. Y.; Lee, C. C.; Fung, K. S.; Hsieh, H. P. Anaplastic Lymphoma Kinase (ALK) Inhibitors: A Review of Design and Discovery. MedChemComm. 2014, 5, 1266–1279.
註6:淺談抗C型肝炎病毒候選藥物DBPR110之發展現況以及技術移轉。《國家衛生研究院電子報第535 期 2014-01-03》,生技與藥物研究所陳志豪博士。
註7:Ho, L. T.; Kulkarni, S. S.; Lee, J. C. Development of sodium-dependent glucose co-transporter 2 inhibitors as potential anti-diabetic therapeutics. Current Topics in Medicinal Chemistry . 2011, 11, 1476-1512.
《文/圖:生技與藥物研究所謝興邦研究員、李靜琪副研究員;審校:生技與藥物研究所陳炯東研究員》