NHRI Communications

知識產權
利用與臨床接軌之人源性腫瘤動物模型加速癌症新藥之開發
The use of clinical relevance patient-derived xenograft animal models to accelerate the discovery of cancer therapeutic drugs
 在癌症新藥研發的過程中,能上市進入臨床使用的抗癌藥物,皆通過極為嚴格的臨床前藥理與毒理等各項評估。在過去的四十多年來,腫瘤醫學界建立許多基礎研究方法與系統生物學的研發策略,作為臨床前活體內、外化合物抗癌活性的測試模型;如從90年代開始,美國國家癌症研究所(National Cancer Institute, NCI)NCI-60藥物開發計畫,以60個不同類型的人類癌細胞株為對象,進行活體外活性分析,並利用這些細胞株建立腫瘤異種移植動物模型(cell line-derived xenograft, CDX);因此,「NCI-60 panel」是目前研究得最詳細、且用來作癌症新藥研發最具代表性的模型1。
在癌症新藥研發的過程中,能上市進入臨床使用的抗癌藥物,皆通過極為嚴格的臨床前藥理與毒理等各項評估。在過去的四十多年來,腫瘤醫學界建立許多基礎研究方法與系統生物學的研發策略,作為臨床前活體內、外化合物抗癌活性的測試模型;如從90年代開始,美國國家癌症研究所(National Cancer Institute, NCI)NCI-60藥物開發計畫,以60個不同類型的人類癌細胞株為對象,進行活體外活性分析,並利用這些細胞株建立腫瘤異種移植動物模型(cell line-derived xenograft, CDX);因此,「NCI-60 panel」是目前研究得最詳細、且用來作癌症新藥研發最具代表性的模型1。人類腫瘤細胞株培養及腫瘤異種移植技術的建立,不可諱言對於腫瘤生物學的進展及癌症新藥的研發,扮演推波助瀾的角色;但殘酷的現實是,在過去新藥的研發過程中,只有5%在臨床前研究具有抗癌活性的試驗化合物,最後能被美國食品藥物管理局(FDA)核准進入臨床使用2。過去利用傳統藥理學研究模型,對轉譯到臨床應用的低預測性,被歸咎於這些模型過於人工化、且缺少能呈現患者腫瘤異質性(heterogeneity)與分子多樣性的特徵。如腫瘤細胞株的建立,經長期培養在人工環境後,已適應腫瘤天然微環境之外的人工環境,致使這些細胞株基因的變異和患者腫瘤因其天然微環境誘導的基因改變,存在極大遺傳分化上之差異;此外,利用細胞株進行小鼠異種移植長出的CDX腫瘤,與實際患者腫瘤的異質性特徵大異其趣,導致研究平台與實際臨床情況多有差距,無法準確預測新穎化合物在癌症患者臨床治療之效益,造成研發失敗,進而阻滯癌症藥物發展的進程。因此,面對腫瘤的分子多樣性,如何選擇正確癌症患者亞群(subpopulation)進行正確的標靶治療,更為癌症治療上的瓶頸與重要的研究課題3。
以肺癌為例,目前晚期肺癌患者的治療,已不像過往一樣每個人皆接受相同的治療藥物,相反的,其治療策略已朝向個人化之醫療發展,會根據患者的細胞形態、基因形態等予以不同的藥物治療。在基因組譜分析的最新進展中,已經鑑定出許多在肺癌中經常突變的基因,其中較常見的為EGFR、KRAS、ALK、HER2、BRAF、PIK3CA、AKT1、MAP2K2、NRAS、ROS1之突變等4。目前具有相同組織學診斷和臨床分期的肺癌,可以藉由基因突變的差異又分成不同的分子亞型(molecular subgroups),並據此發展出基因型特異性的抗癌療法(genotype-specific anticancer therapeutics),如表皮生長因子受體基因(EGFR)抑制劑gefitinib、erlotinib與afatinib等藥物,對表EGFR突變的肺癌細胞—特別是典型的突變位置外顯子(exon)19與21—是治療的首選;這項發現對亞洲人尤其重要,因為30至50%的亞洲病例有EGFR基因突變,尤其是肺腺癌的患者。除了EGFR,致癌基因anaplastic lymphoma kinase(ALK)又為肺癌治療的另一新突破。ALK錯位後與EML4基因結合產生融合基因,會促使腫瘤細胞增生與轉移,並約有4%肺癌的產生源因於ALK的活化,而crizotinib、alectinib等為有效的ALK抑制劑,用於治療ALK基因異常表現的肺癌晚期(局部晚期或轉移性)患者。儘管標靶治療有許多令人振奮的結果,但是這些治療只能在某些特定亞型的患者族群中看到療效。現階段我們對於癌症基因變異的瞭解,以及其產生的功能性之影響,仍然不是十分清楚,致使大多數誘導癌化進展的突變基因,仍然沒有相對應的治療策略。因由EGFR、ALK等抑制劑研發的成功經驗,凸顯了開發有效基因型特異性抗癌療法的緊迫性;因此,科學家有需要去辨識更多的標靶,並利用更具臨床代表性的模型研發更多的標靶藥物,如此才有可能為癌症患者帶來更多的希望。
為了解決此瓶頸,人源性腫瘤細胞異種移殖(patient-derived xenograft, PDX)模型的建立與其分子特徵對應藥物敏感性的分析,受到高度的關注,近年來已成為美國國家癌症研究所發展治療計畫(Developmental Therapeutics Program, DTP),用以評估藥物治療與逆轉抗藥性效益所採用的新穎人類癌症模型5,以及各大藥廠在癌症新藥開發過程中與臨床接軌的重要工具。PDX模型的建立,是指將臨床診斷或治療等目的取出的新鮮腫瘤檢體處理成微腫瘤小塊後,移植到免疫缺陷鼠身上,接著腫瘤小塊會依靠小鼠提供的微環境生長。PDX可以在小鼠體內進行不同代數的繼代,如植入的腫瘤小塊(F0)生長到大約1,000 ~ 2,000立方釐米左右(F1)後,可利用同樣的方法,陸續進行F2、F3、….. Fn 的PDX之建立(圖一)。一般來說,生物活性的檢測,包括藥物抗癌效率、新穎標靶治療之生物標記的檢測等,最好在早期的代數(<F5)前完成3。不同於CDX在小鼠體內所長出的腫瘤,PDX模型能更忠實地保留腫瘤的分子多樣性、分化程度、細胞異質性、腫瘤微環境和組織特徵等;其血管(vasculature)與間質(stroma) 特徵,以及壞死(necrosis)狀態也與人體本身的腫瘤特性更為相近;此外,由於腫瘤微環境相關因子(如腫瘤基質等)會營造藥物抗藥性的環境,進而影響藥物治療的效益,因此,在新藥研發過程運用PDX模型,可提高轉譯到臨床應用的預測性與成功率,以加速新藥開發的效益。
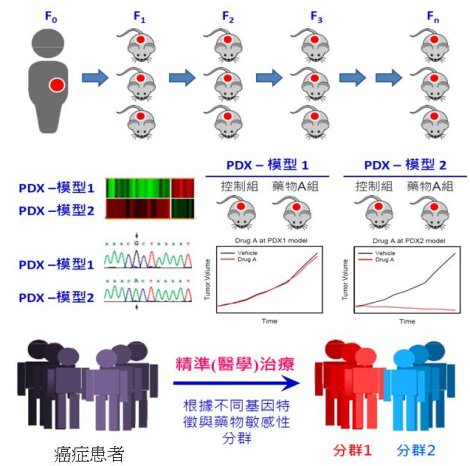
圖一:PDX模式可作為臨床試驗患者治療選擇之依據以加速新藥開發之效益。
PDX模型也是癌症個人化治療(personalized medicine)或精準治療(precision medicine)臨床前研究的絕佳研究工具。因腫瘤存在分子多樣性與異質性,故現今以概全性標準化患者的治療方式,導致有些患者治療非常成功,但有些患者卻無法奏效。精準治療乃是以癌症患者腫瘤的多樣性與異質性差異為考量,所設計的治療策略,如癌症大多由基因突變造成,在確認患者的基因變異特徵後,醫師就能根據這些資訊,選擇正確的患者亞群進行正確的藥物治療;因此,利用所建立的PDX模型,結合各項癌症基因體變異等系統生物學的分析,可進一步將不同基因特徵與藥物敏感性進行分群,不同的分群使用不同治療策略,這對癌症新藥臨床前期評估、治療和預後,具有重要意義,特別是對腫瘤個人化治療與精準治療應用,也具有不可替代的價值(圖一)3。以2015年FDA核准上市的14個癌症新藥為例說明,我們可以看到PDX模型不論在目前FDA核准的適應症,或者其他類型腫瘤、或合併其他藥物治療的效益評估等新適應症之開發,確實扮演推波助瀾的重要角色(請參閱表一)。
PDX能否成功建立,與腫瘤的類型(如鱗狀上皮細胞癌的成功率較腺體腫瘤為高)、癌症的期程(如晚期癌症的成功率較早期為高)、基因變異型態以及接種腫瘤的小鼠使用品系等原因息息相關。免疫缺陷小鼠經常被用作人類細胞或組織的接受者,因其缺乏宿主免疫功能故相對容易地接受異源細胞;傳統上裸鼠(nude mice)和重症聯合免疫缺陷鼠(SCID mice)已用於此目的。近來NOD/SCID/IL-2Rγ-/- 品系的小鼠(如NOG或NSG小鼠),因其嚴重的免疫缺陷,也被證實相較於裸鼠及NOD/SCID小鼠在接受異源細胞上,有更高的效益;與NOD/SCID小鼠相比,NOG小鼠的人體細胞和組織移植的成功率顯著提高。另外,NOG小鼠還能滿足作為人類免疫系統模型的需求,植入人類造血幹細胞後,建立能表達人類T細胞、B細胞與其他血球細胞的擬人化小鼠模型,此模型為進行免疫治療新藥開發之利器。
本院生技與藥物研究所借重感染症與疫苗研究所許素菁副研究員其成功建立擬人化小鼠之長才,共同成立人源性腫瘤異種移植試驗平台研發團隊,並與數家醫院的醫師合作取得腫瘤檢體,啟動PDX平台建立工作,作為後續與臨床接軌的試驗模型,期加速生技與藥物研究所新藥開發之能量,成為亞洲創新藥物卓越中心。
參考文獻:
- Venditti, J.M., Wesley, R.A. & Plowman, J. Current NCI preclinical antitumor screening in vivo: results of tumor panel screening, 1976-1982, and future directions. Adv Pharmacol Chemother 20, 1-20 (1984).
- Hutchinson, L. & Kirk, R. High drug attrition rates--where are we going wrong? Nat Rev Clin Oncol 8, 189-190 (2011).
- Tentler, J.J., et al. Patient-derived tumour xenografts as models for oncology drug development. Nat Rev Clin Oncol 9, 338-350(2012).
- Pao, W. & Hutchinson, K.E. Chipping away at the lung cancer genome. Nat Med 18, 349-351 (2012).
- http://www.cancer.gov/research/areas/treatment/enhancing-drug-discovery.
- Fang, B., Mehran, R.J., Heymach, J.V. & Swisher, S.G. Predictive biomarkers in precision medicine and drug development against lung cancer. Chinese Journal of Cancer 34, 295-309 (2015).
- Hidalgo, M., et al. A pilot clinical study of treatment guided by personalized tumorgrafts in patients with advanced cancer. Mol Cancer Ther 10, 1311-1316 (2011).
- Morelli, M.P., et al. Prioritizing phase I treatment options through preclinical testing on personalized tumorgraft. J Clin Oncol 30, e45-48 (2012).
- Sette, G., et al. Mek inhibition results in marked antitumor activity against metastatic melanoma patient-derived melanospheres and in melanosphere-generated xenografts. J Exp Clin Canc Res: CR 32, 91 (2013).
- Kemper, K., et al. Intra- and inter-tumor heterogeneity in a vemurafenib-resistant melanoma patient and derived xenografts. EMBO Mol Med 7, 1104-1118 (2015).
- Krepler, C., et al. Personalized pre-clinical trials in BRAF inhibitor resistant patient derived xenograft models identify second line combination therapies. Clin Cancer Res (2015).
- http://mct.aacrjournals.org/content/12/11_Supplement/B156.short.
- Gu, Q., et al. Genomic characterization of a large panel of patient-derived hepatocellular carcinoma xenograft tumor models for preclinical development. Oncotarget 6, 20160-20176 (2015).
- Wiegering, A., et al. E7080 (lenvatinib), a multi-targeted tyrosine kinase inhibitor, demonstrates antitumor activities against colorectal cancer xenografts. Neoplasia (New York, N.Y.) 16, 972-981 (2014).
- http://www.cancer.gov/about-cancer/treatment/clinical-trials/search/view?cdrid=774639&version=HealthProfessional&protocolsearchid=13634893.
- https://www.smartpatients.com/trials/NCT02496663.
- https://clinicaltrials.gov/ct2/show/NCT02496663.
- https://pharmacologyupdate.wordpress.com/2015/05/14/fda-approves-ibrance-for-postmenopausal-women-with-advanced-breast-cancer/.
- https://blogs.shu.edu/cancer/2015/06/03/ibrance-plus-faslodex-improves-outcomes-in-hr-breast-cancer/.
- http://cancerres.aacrjournals.org/content/68/9_Supplement/2442.
- Chen, F., et al. New horizons in tumor microenvironment biology: challenges and opportunities. BMC Medicine 13, 45 (2015).
- http://cancerres.aacrjournals.org/content/70/8_Supplement/2598.abstract.
- http://ir.genmab.com/releasedetail.cfm?releaseid=881156.
- van Rhee, F., et al. Combinatorial efficacy of anti-CS1 monoclonal antibody elotuzumab (HuLuc63) and bortezomib against multiple myeloma. Mol Cancer Ther 8, 2616-2624 (2009).
《文/圖:生技與藥物研究所郭靜娟副研究員、石全特聘研究員兼所長》