NHRI Communications

院務紀事
2016 NHRI Research Day優秀論文口頭報告、壁報論文及優秀研究助理獎勵評選活動紀實
NHRI announces recipients of Research Day Awards for Outstanding Papers, Posters, and Research Assistants
 為鼓勵本院年輕研究人員踴躍發表論文及表彰本院研究助理對研究工作之傑出貢獻,特於3月22至23日辦理2016 NHRI Research Day進行優秀論文口頭報告、壁報論文及優秀研究助理評選活動暨頒獎儀式。到職滿一年之博士後研究員及博士班4年級以上學生均應發表論文並開放自由投稿,本年度參與口頭報告13篇(含單位推薦及自由投稿)、壁報論文145篇;而本年度獲得單位推薦參與評選之優秀研究助理共計有33名。
為鼓勵本院年輕研究人員踴躍發表論文及表彰本院研究助理對研究工作之傑出貢獻,特於3月22至23日辦理2016 NHRI Research Day進行優秀論文口頭報告、壁報論文及優秀研究助理評選活動暨頒獎儀式。到職滿一年之博士後研究員及博士班4年級以上學生均應發表論文並開放自由投稿,本年度參與口頭報告13篇(含單位推薦及自由投稿)、壁報論文145篇;而本年度獲得單位推薦參與評選之優秀研究助理共計有33名。 評選作業:由院內研究人員組成評選委員會
- 口頭報告組:由各單位推薦人選,並開放自由投稿,於Research Day進行英文口頭報告,競爭傑出、優選及佳作獎。
- 壁報展示組:投稿分為三領域,包括基礎醫學領域79篇、應用醫學領域41篇、臨床醫學/公衛25篇,各領域取前10%之優秀壁報論文。
- 優秀研究助理:採二階段審查,第一階段由單位推薦、第二階段於Research Day進行評選,擇優取20名予以獎勵。

本年度優秀論文口頭報告傑出獎及優選獎獲獎人研究內容介紹如下:
 傑出獎:阮振維博士
傑出獎:阮振維博士為免疫醫學研究中心高承源助研究員實驗室博士後研究員,研究主題為:Deficiency of dual-specificity phosphatase 6 increases resistance to diet-induced dysbiosis of gut microbiome in mice。近年來已證實微生物相(microbiota)對於動物的代謝扮演重要的角色。得利於次世代定序(NGS)的快速發展,得以不透過細菌培養,藉由元基因體(metagenome)分析得到全面的菌相組成資訊。研究主題發現dusp6基因剔除小鼠擁有獨特的腸道菌相(gut microbiota),將此菌相移植給無菌鼠後,能有效提高能量消耗,並抑制高油脂飼料所造成之肥胖。利用RNA定序(RNA-seq)分析dusp6基因剔除小鼠的小腸轉錄體(transcriptome),研究團隊發現剔除dusp6基因能活化Ppar訊號並加強緊密連接(tight-junction)蛋白的表達,透過改變腸道環境而產生抑制肥胖之菌相。當高油脂食物使腸道菌相失調並引起發炎反應時,dusp6基因剔除小鼠能明顯抑制腸道發炎反應並維持腸道菌相的平衡,尤其是提高Bacteroidetes類的細菌比例以對抗高油脂飲食所帶來之發炎壓力。此研究首度發現透過調控遺傳因子,能維持有利於能量代謝並抵抗發炎的腸道菌相,甚至能對抗高油脂食物所引起之腸道菌相失衡。未來將利用此研究所建立之腸道菌相分析與培養平台,積極發展疾病導向的微生物體治療技術。
獲獎短評:Microbiota為目前熱門研究領域之一,該研究證實dusp6基因剔除小鼠的腸道菌相能有效幫助宿主對抗肥胖,研究具創新性且深入而完整,頒給傑出獎以資肯定。
 優選獎:邱于庭博士生
優選獎:邱于庭博士生 為分子與基因醫學研究所喻秋華研究員實驗室博士班研究生,研究主題為:Ribose-5-phosphate isomerase a (RPIA) overexpression promotes colorectal cancer formation via activation of β-catenin pathway。研究發現為參與五碳醣磷酸路徑之一重要酵素核醣5磷酸異構酶過度表現於大腸直腸癌中,藉著穩定β-catenin並進核與β-catenin形成複合體進而促成腫瘤發生。原本已知核醣5磷酸異構酶(uibose-5-phosphate isomerase, RPIA)參與在五碳醣磷酸路徑(pentose phosphate pathway, PPP)的非氧化相,負責將ribulose-5-phosphate轉變成ribose-5-phosphate。此研究首先發現約有75%的大腸直腸癌患者其RPIA不論RNA或蛋白質都比正常組織具有高表現,進一步也發現RPIA蛋白質表現在細胞核內並與β-catenin呈現正相關。利用不同片斷的RPIA發現其促細胞增生的功能區域為C端胺基酸序列(868-936),不同於其原本落在異構酶N端的功能及催化區域。RPIA藉由其C端與β-catenin及APC 形成複合體,減少β-catenin被降解使穩定β-catenin的蛋白質量,並活化β-catenin下游基因的表現,進而促使大腸直腸細胞不正常增生產生癌化。利用腸道啟動子專一表現人類RPIA在斑馬魚的腸道之動物模式中,於3到5個月大的轉基因魚,發現大量表現RPIA促使β-catenin蛋白質過度表現並進入細胞核,且觀察到細胞不正常增生及核質比變大的現象,同時細胞週期及增生相關基因表現增加,藉此證實了大量表現RPIA可誘導細胞癌化。這項研究揭示了RPIA在大腸直腸癌的形成上扮演了全新的功能,期許能發展RPIA成為新的標的分子,作為未來大腸直腸癌的預測及治療方針。
獲獎短評:本項研究有別對RPIA現有之瞭解,具新穎性且研究內容完整,值得更進一步的發展及思考,頒給優選獎以資肯定。
優選獎:賴朝陽博士
為免疫醫學研究中心莊宗顯副研究員實驗室博士後研究員,研究主題為Identification of thiostrepton as a novel inhibitor for psoriasis-like inflammation induced by TLR7–9。研究內容為開發新穎的類鐸受體7、8及9(TLR7-9)抑制劑以應用於發炎疾病的治療。TLR7-9的過度活化與發炎性免疫性疾病如牛皮癬的發病機理有關,因此,這些類鐸受體的抑制劑已逐漸被開發,用以研究於治療這些疾病。為了開發新穎的類鐸受體7、8及9的抑制劑,研究團隊利用比較藥物所刺激之基因表現圖譜相似性的原理,比對了基因表達資料庫內已知的TLR7-9抑制劑與其他化合物。發現硫鏈絲菌素(thiostrepton,一種天然抗生素)可能有抑制類鐸受體活化的功能。進一步的研究顯示,硫鏈絲菌素可抑制由類鐸受體7、8及9所引起的NF-κB的活化,並抑制由TLR7-9 配體(ligands)如R848、CpG-ODN與LL37/DNA或LL37/RNA複合物(大量表達於牛皮癬患部之複合物)刺激樹突狀細胞產生細胞激素。硫鏈絲菌素是經由抑制蛋白酶體(proteasome)的功能以及內含體(endosome)酸化的功能,來抑制類鐸受體7、8及9的活化。以不同的動物模式研究顯示,硫鏈絲菌素可以減弱在牛皮癬疾病中由類鐸受體所引起的發炎反應。這些結果表明,硫鏈絲菌素是一種新穎的類鐸受體7、8及9抑制劑。
獲獎短評:本研究利用老藥新用的方法,將硫鏈絲菌素應用在由類鐸受體7、8及9不適當地激活下所引起的免疫疾病上,具有重要性及潛在的應用性,頒給優選獎以資肯定。
優選獎:邱慶豐博士
為癌症研究所蘇振良副研究員實驗室博士後研究員,研究主題為NF-κB driven suppression of FOXO3a contributes to EGFR mutation-independent Gefitinib resistance;探討肺癌吉非替尼(Gefitinib)抗藥性及癌幹原性(cancer stemness)相關的分子機制。肺癌患者中有85%屬於非小細胞肺癌(non-small cell lung cancer, NSCLC),將近70%的NSCLC患者在診斷時已屬局部晚期或發生轉移,而無法接受手術治療。吉非替尼是一種小分子的細胞表皮生長因子接受器酪胺酸激酶抑制劑(EGFR tyrosine kinase inhibitors, EGFR-TKIs),可有效抑制癌細胞增生、轉移以及腫瘤血管新生,特別對於EGFR基因突變的NSCLC肺癌患者。EGFR-TKIs在台灣已獲准作為惡性肺癌患者第一線標靶治療藥物,但是在臨床上陸續出現患者對於EGFR-TKIs的治療效果不佳,或產生抗藥性。研究團隊發現FOXO3a蛋白的表現與肺癌患者在EGFR-TKIs的藥效反應和存活率有高度正相關,並且是不同於已知的EGFR突變的訊息傳遞路徑。進一步在吉非替尼抗藥性的NSCLC肺癌細胞株中,發現NF-κB經由誘導微型核糖核酸(miR-155)的生成,而抑制FOXO3a的表現,導致NSCLC肺癌細胞增加癌幹原性和吉非替尼抗藥性。此研究發現NF-κB/miR-155/FOXO3a可能是一個新型調控肺癌對EGFR-TKIs抗藥性的路徑。此發現可提供肺癌患者在檢測EGFR-TKIs抗藥性的參考標誌,而進一步作用在NF-κB/miR-155/FOXO3a可能具有提升肺癌患者對EGFR-TKIs的敏感性。
獲獎短評:EGFR-TKIs為目前臨床上使用惡性肺癌患者之標靶藥物,但抗藥性的問題已陸續出現。肺癌患者在接受EGFR-TKIs前,EGFR基因突變檢測,可預期EGFR-TKIs治療的反應和存活率,此新的抗藥機轉研究可開啟未來進一步檢測EGFR-TKIs抗藥性和改善吉非替尼抗藥性的新方向。本項研究具重要的臨床價值和意義,頒給優選獎以資肯定。
優秀論文獲獎名單如下(依照單位及姓名筆劃順序排列):

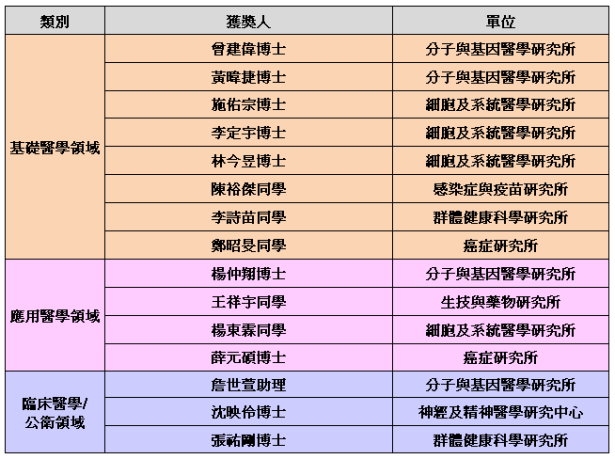
優秀壁報論文獲獎名單如下(依照單位及姓名筆劃順序排列):
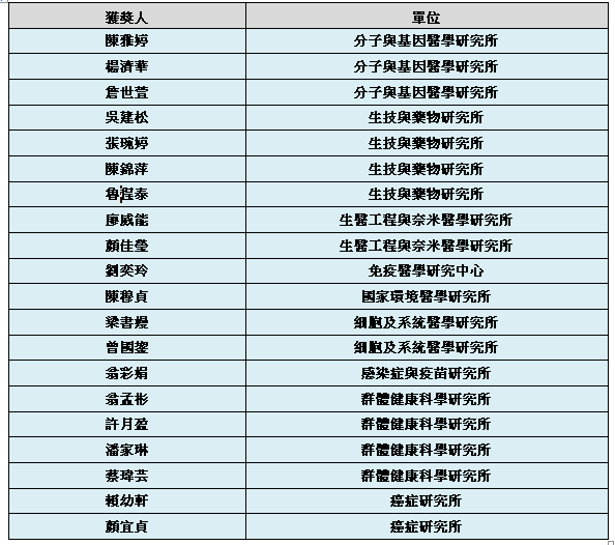
優秀研究助理獎勵獲獎名單如下(依照單位及姓名筆劃順序排列):
《文/圖:免疫醫學研究中心阮振維博士、賴朝陽博士、分子與基因醫學研究所邱于庭博士生、癌症研究所邱慶豐博士提供;學術發展處蔡雨軒整理》