NHRI Communications

知識產權
生物藥研發-藥動面面觀
Development of Biologics: Pharmacokinetic aspects
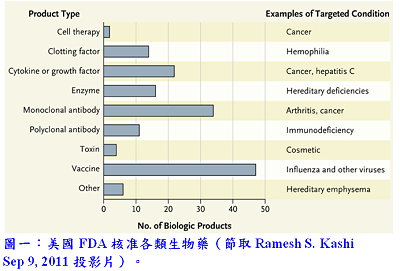 生物藥藥物研發與藥動學
生物藥藥物研發與藥動學利用生物方法生產人類生長激素和胰島素已將近40年。近年來因為重組蛋白技術的成熟,以蛋白質作為治療藥物已有越來越多的趨勢(圖一);這些蛋白質產品融合了生物和藥理元素而產生許多抗體衍生物(例如:antibodies、Fabs、scFvs)、抗體藥物複合物(ADC)、原生和非原生的融合治療蛋白質產物(fusions of therapeutic proteins with native and non-native products)和雙特異性抗體治療蛋白融合(bispecific antibodies),這些極具潛力以蛋白質為基礎的藥物,不論在臨床上或疾病治療上均產生極大的影響力。過去15年來,由於對蛋白質藥物治療與藥物動力機轉研究的需求日益增加,不僅建立明確生物藥藥物動力技術,而且也鋪成許多理論性設計的新型療法。今日,超過40種單株抗體藥物與可結晶區(fragment crystallizable region, Fc)融合治療藥物在美國銷售,並有超過四百多種生物藥在臨床開發階段,並評估其治療各種疾病的可能性,包括癌症、免疫功能不全和傳染性疾病。然而,儘管有一些正向的結果,卻只有約12%生物藥通過臨床試驗並進入市場;造成如此高的淘汰率有幾項因素,其中,生物藥缺乏療效往往被認定為主要原因。然而要達到最優化效能要求,最重要的就是是否能夠傳遞足夠有效藥物濃度於標的器官。
事實上,提高臨床成功率的關鍵因素即是要有足夠藥物暴露在標的而產生療效,而其可用藥物動力學(簡稱藥動學)配合藥物藥效學來達成此目標。一般而言,在藥品開發中,藥物動力及藥物藥效學為不可獲缺的一環,而藥動學一般可區分為臨床前(體外及動物)與臨床(人體)藥動學試驗階段。藥動學主要是瞭解藥品在生物體內的吸收、分布、代謝與排泄各個過程的表現與特性;藥品要產生作用,需要經過吸收過程然後由血液循環運送分布至全身,進到人體特定作用部位產生療效;因此使用藥物治療時,常須要維持一定的有效血中藥物濃度,以便在作用部位有足夠的藥量維持療效。然而,藥動學需要有優良、最適化且精確的分析方法,以提供從開發藥品前期體外藥物代謝試驗、至動物體內藥物代謝試驗及臨床前藥動學試驗正確的藥動力評估,並將臨床前藥動學資料連結至臨床階段的第一期藥動學試驗,以完全掌握開發中藥品於生物體內的各種動態1,2,3。
生物藥與小分子藥物的藥動學差異
與小分子藥物相比,生物藥在吸收、分布、代謝和排除方面具有獨特的藥動特點,導致在其發展中的顯著差異。生物藥與小分子藥物的主要區別是它們的大小、結構的複雜性和它們製造的方式;小分子藥物分子量通常是少於1 kDa,而生物藥分子量範圍較廣,從幾kDa到1000 kDa。治療用的蛋白質藥物療效和安全性也會受到它們二、三及四級結構的影響,因此,考慮生物藥的功能因素時,必須要包括蛋白質折疊、變性、氨基酸的替換、脫醯胺、氮和碳-末端的修改、蛋白質聚合、氧化、氧氮-連接糖基化、截斷、磷酸化、硫酸鹽化、聚乙二醇化、甲醯/羧化/乙醯化、多聚體解離、錯置的雙硫鍵、脂肪醯化、γ-carboxyglutamylation、甲醯化和甲基化等因素。與小分子藥物相比,生物藥依賴淨電荷、胎兒Fc受體(FcRn)、糖基化、聚乙二醇修飾或聚合的幾個因素,具有不同的理化性質以及展示獨特和複雜藥物動力學特徵。雖然在生物藥及小分子藥物藥動原理是一致的(即經過吸收、分布、代謝、排泄的過程),但生物藥的分布、代謝、排泄的基礎機制與小分子藥物差別很大。與小分子相比,生物藥的單株抗體等更傾向於有較慢的吸收速度、較小的分布,以及不同機制排除速率而造成有較長的半衰期,且大部分的生物藥用血液傳送,並通常針對一個特定具體標的。此外,體內清除小分子藥物主要是透過肝臟代謝或腎膽汁排泄,但與此相反的是,生物藥如單株抗體主要是通過細胞內的溶酶體蛋白水解降解來排除。另外,生物藥潛在的藥物交互作用機轉本來就很複雜,因其交互作用機制涉及細胞因素,導致藥物代謝酶的變化4。圖二中顯示生物藥與小分子藥物藥動學上相互差異處即生物藥與小分子藥物雖然其藥動上基本觀念相同,但其藥動所附加的過程及決定因子可能不同。
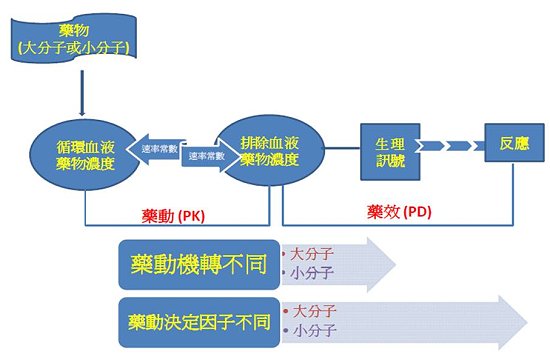
圖二:生物藥與小分子藥物藥動學上之相互差異處。
生物藥的藥動學所面臨的挑戰
當前生物藥的藥動學所面臨的挑戰可分為生物樣品分析及藥動機制兩大面項。
- 生物藥品分析
生物藥藥物的開發成功,需要應用可靠的生物分析方法於藥動學、毒理動力學和生體可利用率資料分析上,使藥物在生物體液(血漿、尿液、組織等)的量化更精確。在生物藥藥物分析上,最主要的分析方法為配位鍵的結合方式(ligand binding assay, LBA),但其方法有其缺點存在,例如須找尋較合適的抗體且較費時,抗體的專一性及內生性蛋白質在分析定量上的影響均為判定分析定量精確性的重要指標。在目前,由於生物技術進步,有越來越多極具潛力蛋白質為基礎的藥物發展為生物藥的候選藥物。其中一項趨勢即是越來越多生物藥分析使用液相層析(串聯)質譜儀(LC–MS/MS)取代配位鍵結合實驗(LBA),測定生物樣品中蛋白質,因其快速、方便、高選擇性及高靈敏性,進而改進選擇性和線性動態範圍5。
- 藥動機制
(1)影響生物藥藥動學因素
如前所述,生物藥和小分子藥物的藥動基本原理相當,但是主導生物藥的藥動過程機制完全不同。(a)吸收:由於生物藥藥物分子量和粒子大小、親水性、不同溶解度、有限的化學穩定性和胃腸道降解有關,因此其口服生體可利用率是可以忽略不計。生物藥通常由腸道外給予藥物,例如:靜脈注射、皮下或肌肉注射,但通常肌肉和皮下僅用於效價較高的生物製品,或當藥品有其有限的溶解度(~ 100 毫克/毫升)或是受到給予最大容受液體體積的限制(肌肉 ~ 5毫升或皮下2.5 毫升)。因此,一般而言,大多數的生物藥經由靜脈給藥,以減少患者的依從性。(b)分布:因為生物藥具有較大的分子尺寸(分子量及粒子大小),不同於小分子藥物的物化、結合性質、給藥途徑和生產製程。一般而言,生物藥從血液向外周組織分布非常有限,而且很慢;主要是利用其高親和力特性而達到與標的結合,但受限於更高密度及緊密結合的組織細胞,使生物藥難以滲透至標的組織,因而造成有限的體積分布。(c)生物藥從血液循環或間質液通過而排出,其中包括幾種機制︰非特異性細胞內吞噬作用、降解蛋白質水解、Fcγ受器介導的清除、標的介導的清除和形成免疫複合物。生物藥的排除是高度依賴結構(包括糖)、電荷(密度和分布)、粒子大小和親水性/油性,而非特異性蛋白水解酶可能廣泛存在於體內,或可能只限於特定的器官和組織,因此,生物藥可能代謝在各種身體器官(肝臟、腎臟)、血液和血管外。生物藥從人體排出的兩種一般途徑為︰代謝/分解代謝和排泄,另外有許多因素如電荷、大小、FcRn結合和標的親和力、次IgG類、糖基化程度和類型、注射途徑和部位,均可以影響生物藥的藥動表現,更有可能影響其療效和安全性4,6,7。
(2) 交互作用
為了提高生物藥於臨床上的療效,越來越多生物藥被用來與小分子藥物和/或其他生物藥同時使用。一般而言,生物藥是不通過細胞色素 P450(CYP)酶代謝,但是,有些生物藥可以從周圍血液單個核細胞觸控發炎性細胞激素的釋放(如 IL-1,IL-6、INF-γ和TNF-α),而回應釋放的反應以及回應發炎或感染,並造成體內細胞激素調節多種生理過程,包括藥物運輸和代謝。因此,經由細胞激素介導抑制藥物代謝酶,能改變同時使用的藥物,從而沉澱並與生物藥產生藥物相互作用(DDIs)。一般而言,生物藥是認為比其他口服藥物較不會產生藥物相互作用;因此,在臨床上,同時給予兩個或更多生物藥的機會將會亦日益增加。到目前為止,只有有限的資訊說明生物藥可能的交互作用,如生物藥之間或生物藥和小分子藥物。日後對於充分瞭解標的的功能作用、標的的表達和其標的下游所產生的結果,皆是評估藥物相互作用極為重要的一項指標7。
(3) 藥動模式
目前,應用生物藥藥物研發常用的藥動藥效模式可分為:以機轉為基礎的藥動學/藥效學(PK-PD)模式、生理藥動(PBPK)模式及定量上結合PBPK及標的介導的藥物分布(target-mediated drug disposition, TMDD)。由於群體藥動學分析中已成功處理應用於生物藥變數的評估,因此藉由不同機制如標的介導的藥物分布和生理藥動模式進行預測,可成功預測生物藥藥動特性,突顯出生物藥藥動於優化藥物開發和未來臨床實驗相關問題的挑戰8。
生物藥發展中常見臨床藥理學的問題大約可分為以下4種9:
- 藥物—藥物相互作用(DDIs):生物藥雖然與小分子藥物一樣,可能發生潛在藥物-藥物相互作用的可能性,但是相較於小的分子,它們大多較輕微且不常發生,因為生物藥在清除機制上與小分子有顯著差異性。
- 生物藥的心臟再極化(QT)間期延長:生物藥的QT間期測量,在一般情況下,單株抗體藥物並不需要進行監測研究;然而,在早期臨床發展階段則建議廣泛的進行心電監測心臟安全,尤其是小的生物治療藥物(< 5 kDa),與心臟和/或血管系統目標或標的具有相同的性質的生物藥。
- 生物製品的免疫原性:由於生物製品粒子的大小和人體免受異物侵入保護機制,使用生物藥對於免疫原性的議題特別值得關注。免疫原性可能產生的後果包括喪失療效和嚴重威脅生命的不良反應,保護機制為強化一般免疫反應或交叉反應藥物抗體複合體(anti-drug antibody)與內源性物質,此為維持正常生理功能之關鍵。因此,在生物藥的研究上,降低潛在免疫原性的不良反應的風險策略,應在早期階段即開始制定並實施。
- 特定人群:生物藥對於成人、幼兒、性別及不同種族間,其臨床使用方式與小分子藥物相似,例如,建議使用群體藥動學和基於稀疏採樣方式來提高療效。除了一般的藥動學、藥效學和藥理作用考量外,基於患者自身的特性,給予每個人的生物產品亦當應基於其自身的特點。
由小分子藥物開發至生物藥研發,雖然其經驗可為借鏡,但是生物藥並不只是一個大分子而已。與小分子藥物相比,有不同的物化性質,並且展現出更複雜的藥動型態,因而更會影響臨床前及臨床發展策略。雖然,目前對於生物藥藥動學機制瞭解層面快速地增加,也解決了許多基本的生物藥藥動學問題,但是,仍然有許多生物藥藥動學根本問題仍有待解決。例如,如何適切地轉譯生物藥藥動學資料、從動物到人體或從體外到體內的相關性連結,進而利用數據資料提升藥物開發的成功率,更進一步的提供更安全和更有效的藥物;此外,商品的成本和使用方便性,以及利用蛋白質工程改善生物藥蛋白質療法,並利用藥動學機制評估和結構活性關係的相關性等。儘管目前仍然存在著許多未解決的問題,但於藥物市場上,許多的生物藥已具高利益和低風險比率,並也為無數患者提供更好的療效。本院生技與藥物研究所亦結合院內其他研究單位如癌症研究所、感染症與疫苗研究所、生醫工程與奈米研究所、細胞與系統醫學研究所及神精及精神醫學研究中心等從事生物藥的藥物研發,相信不久的將來會有豐碩的成果展現。
參考文獻:
- Reichert J. Marketed therapeutic antibodies compendium. Mabs, 4, 413-15, 2012.
- Berggren R., Moller M., Moss R. et al. Outlook for the next 5 years in drug innovation. Nat Rev Drug Discover, 11, 435, 2012.
- Thomas G. Fundamentals of Medicinal Chemistry, 2nd John Wiley & Sons. Inc, 2007.
- Baumann A. Early development of therapeutic biologics-pharmacokinetics. Curr Drug Metab, 7: 15, 2006.
- Broek I., Niessen W., and Dongen W. Bioanalytical LC-MS/MS of protein-based biopharmaceuticals. J Chromatogr B, 929, 2013.
- Shi S. Biologics: An update and challenge of their pharmacokinetics. Curr Drug Metab, 15, 271, 2014.
- Wang, W., Wang EQ, Balthasar J. Clin Pharmacol Ther, 5: 548-58, 2008.
- Hansel T., Kropshofer H, Singer T. et al. The safety and side effects of monoclonal antibodies. Nat Rev Drug Discover, 9, 325, 2010.
- Zhao L., Ren T., and Wang D. Clinical pharmacology considerations in biologics development. Acta Pharmacologica Sina, 33, 1339, 2012.
《文/圖:生技與藥物研究所葉燈光副研究員、石全特聘研究員兼所長》