NHRI Communications

研究發展
斑馬魚是一可用於研究人類遺傳疾病的動物模式—以家族性滲出性玻璃體視網膜病變為例
Zebrafish has been established as a useful model for human genetic diseases - familial exudative vitreoretinopathy as an example
 家族性滲出性玻璃體視網膜病變(familial exudative vitreoretinopathy, FEVR)是一種異源性(heterogeneous)遺傳疾病,其特徵是異常血管形成於周圍的視網膜,導致視網膜脫離和嚴重的視力障礙;臨床上發現,患者有家族內的病徵差異及雙眼間的病徵嚴重性不對稱等特徵。至今,已鑑定及驗證有5個基因(FZD4、LRP5、TSPAN12、NDP和ZNF408)的缺失會造成FEVR。前4個已被證明參與Norrin(NDP基因的產物)誘導的FZD4/β-catenin訊息通路,而ZNF408的參與機制則尚未清楚。雖然如此,只有大約50%的患者其病變是由這5個基因中的一個的缺失所造成,另外的50%的患者則病因未知。
家族性滲出性玻璃體視網膜病變(familial exudative vitreoretinopathy, FEVR)是一種異源性(heterogeneous)遺傳疾病,其特徵是異常血管形成於周圍的視網膜,導致視網膜脫離和嚴重的視力障礙;臨床上發現,患者有家族內的病徵差異及雙眼間的病徵嚴重性不對稱等特徵。至今,已鑑定及驗證有5個基因(FZD4、LRP5、TSPAN12、NDP和ZNF408)的缺失會造成FEVR。前4個已被證明參與Norrin(NDP基因的產物)誘導的FZD4/β-catenin訊息通路,而ZNF408的參與機制則尚未清楚。雖然如此,只有大約50%的患者其病變是由這5個基因中的一個的缺失所造成,另外的50%的患者則病因未知。國立陽明大學生命科學系暨基因體科學研究所鍾明怡副教授及台北榮民總醫院視網膜科陳世真主任經由分析FEVR患者檢體、家族史、外顯子測序(exome sequencing),發現了在RCBTB1(regulator of chromosome condensation (RCC) and BTB domain-containing protein 1)基因上的變異可能是造成FEVR的原因。進一步用細胞培養及分生的方法,證明了RCBTB1對Norrin或Wnt3a(Wingless-type mmtv integration site family, member 3a)誘導的Wnt/β-catenin訊息通路活化是必要的。此外,本院分子與基因醫學研究所江運金副研究員研究團隊(助理朱國彰實際操作相關實驗)與國立陽明大學及台北榮民總醫院團隊合作,使用斑馬魚驗證了RCBTB1的表現減量(使用反股嗎啉基寡核苷酸morpholino,抑制蛋白轉譯)會造成視網膜的血管病變(圖一);進一步更證明了rcbtb1與ndp兩基因的缺失對視網膜的血管病變有加成作用(圖二),表示遺傳上RCBTB1能與Norrin誘導的Wnt/β-catenin訊息通路一起作用。這些結果與由細胞培養研究中所獲得的結果是相符合的,並也互相印證。為了證明基因減量(knockdown)的專一性,研究團隊同時注射人類RCBTB1的mRNA與RCBTB1的morpholino於斑馬魚胚胎中,發現表型可回復得比較正常;相反地,患者的變異RCBTB1 mRNA就無回復表型的效果。研究團隊也使用了另一種方法(CRISPR interference,抑制基因轉錄)來達成基因減量的功能,胚胎同樣有視網膜的血管病變。這些實驗顯示了研究團隊用的基因減量法是專一的,而且沒有產生脫靶(off-target)效應;此研究論文以共同通訊作者發表於4月份Human Molecular Genetics。
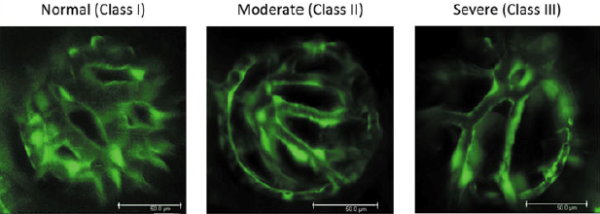
圖一:以morpholino達成斑馬魚胚胎基因減量,探討rcbtb1的表現程度對視網膜的血管病變之影響。隨著rcbtb1表現量的減少,血管病變程度可分為3種:正常(Class I)、中度病變(Class II)及重度病變(Class III)(詳註一)。
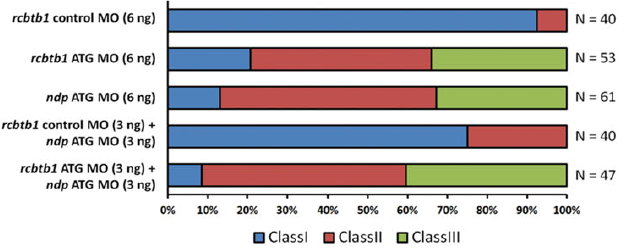
圖二:以半定量分析,探討不同基因組合之缺失對視網膜的血管病變之影響(詳註二)。rcbtb1及ndp兩基因同時基因減量, 對視網膜血管的表型嚴重性有加成的作用。
此外,江博士研究團隊已自位於德國Karlsruhe Institute of Technology(KIT)的歐洲斑馬魚資源中心(EZRC)購得了rcbtb1缺失的變異種,待牠們長成成魚,研究團隊將可進一步研究,如在成魚視網膜的血管表型,用基因微陣列(microarray)發現轉錄體(transcriptome)的差異,可提供rcbtb1如何參與Norrin誘導的Wnt/β-catenin訊息通路的線索;也可用此變異種去篩選能讓視網膜血管長好的小分子藥物等。
整體而言,由於斑馬魚具有胚胎透明、體外受精、體外發育、繼代快、成本低、有許多有利研究的轉殖魚和變異種可用,以及多種基因操作技術成熟等優點,且基因組與人類有87%的高度同源性,是研究人類遺傳疾病的另一種可選擇且方便使用的動物模式。
註一:Functional characterization of Rcbtb1 through morpholino (MO)-mediated gene knockdown in zebrafish embryos. rcbtb1 morphants exhibited moderate defects in IOV (intraocular vessels) development. The images depict the IOVs of fli1: EGFP transgenic zebrafish larvae at 4 dpf (days post-fertilization). Phenotypes of the IOVs were categorized into three classes: baseline (class I), moderately affected (class II) and severely affected (class III). The IOVs in class I had a normal width and a regular radial configuration, with an avascular area occupied <25% of the total space. Those in class II had narrow and less regular radial vasculatures with an avascular area ranging between 25% and 50%. Class III morphants bear the most severe phenotypes with >50% avascular area. (modified from Wu, et al. Hum. Mol. Genet. 2016:25: 1637–1647).
註二:Semi-quantitative analyses of IOV phenotypes in morphants of different combinations. In morphants injected with the control MO (6 ng), rcbtb1-ATG MO (6 ng), ndp ATG MO (6 ng), or combinations of 3 ng of the rcbtb1 control or ATG MO with 3 ng of ndp ATG MO. At least 40 larvae per condition from three independent experiments were evaluated. Note that rcbtb1 and ndp show a synergistic effect. (modified from Wu, et al. Hum. Mol. Genet. 2016:25: 1637–1647).
《文/圖:分子與基因醫學研究所江運金副研究員》