NHRI Communications

研究發展
發現抑制TGF-β之癌症轉移功能的新細胞激素:GDF10/BMP3b
NHRI researcher reports loss of GDF10/BMP3b as a prognostic marker collaborates with TGFBR3 to enhance chemotherapy resistance and epithelial-mesenchymal transition in oral squamous cell
 癌症細胞為因應環境壓力,會表現出一些較原始的特徵來增加適應能力,如去分化、出現胚胎時期特性(stemness)、表皮—間質細胞轉型(epithelial to mesenchymal transition, EMT)等;這些細胞生理的變化與腫瘤微環境中的細胞激素的變化及消長息息相關。生長因子(或細胞激素)是體內不可缺少的功能蛋白,從受精卵到器官的胚胎發育,一直到身體組織的生長與受損修復等,都需要生長因子。生長因子的調節常常是由一群因子的網絡來平衡控制,例如,轉化生長因子-β(transforming growth factor-β, TGF-β)就屬TGF-β家族,家族之中的成員常可互相活化或抑制。TGF-β會在不同環境條件下,影響細胞的生長、分化或細胞凋亡;在胚胎時期調節EMT、在修復受損組織時,促進生長與增殖。本篇研究的主角:生長分化因子—10(growth differentiation factor-10, GDF10),又名骨型態分化蛋白3b(bone morphogenetic protein-3b, BMP3b),也是TGF-β家族中的一員。
癌症細胞為因應環境壓力,會表現出一些較原始的特徵來增加適應能力,如去分化、出現胚胎時期特性(stemness)、表皮—間質細胞轉型(epithelial to mesenchymal transition, EMT)等;這些細胞生理的變化與腫瘤微環境中的細胞激素的變化及消長息息相關。生長因子(或細胞激素)是體內不可缺少的功能蛋白,從受精卵到器官的胚胎發育,一直到身體組織的生長與受損修復等,都需要生長因子。生長因子的調節常常是由一群因子的網絡來平衡控制,例如,轉化生長因子-β(transforming growth factor-β, TGF-β)就屬TGF-β家族,家族之中的成員常可互相活化或抑制。TGF-β會在不同環境條件下,影響細胞的生長、分化或細胞凋亡;在胚胎時期調節EMT、在修復受損組織時,促進生長與增殖。本篇研究的主角:生長分化因子—10(growth differentiation factor-10, GDF10),又名骨型態分化蛋白3b(bone morphogenetic protein-3b, BMP3b),也是TGF-β家族中的一員。TGF-β對於癌症發展是十分矛盾的,它具有雙面刃般兩種截然不同的影響。一方面能誘導癌細胞走向細胞凋亡,另一方面卻又會促使腫瘤細胞進行EMT而轉移,完全視當時環境及狀態而定。當轉變成腫瘤細胞時,大量TGF-β會造成細胞增殖、刺激周圍的基質纖維母細胞合成大量膠原蛋白,造成組織的纖維化、抑制免疫系統,以及促進血管新生,使腫瘤更具侵略性。本院癌症研究所李岳倫副研究員研究團隊發現,TGF-β的功能可能被GDF10/BMP3b 所抑制調控。GDF10/BMP3b原本的功能是在胚胎發育時期,調控細胞分化的因子,且在細胞不需要分化時消失;之前與癌症相關的研究不多,只知GDF10/BMP3b扮演著腫瘤抑制基因的角色,但詳細的機制,目前尚無著墨。的確,李博士研究團隊研究發現,GDF10/BMP3b在口腔癌細胞以及在口腔癌患者的腫瘤檢體中都有減少的趨勢。機制方面顯示,過量表現GDF10/BMP3b後,會誘發細胞凋亡、抑制口腔癌細胞株的生長、抑制口腔癌細胞之EMT。有趣的是,研究團隊進一步從資料庫比對中發現,GDF10/BMP3b與TGF-β的第三型受體TGFBR3的表現呈現正相關,找到了GDF10/BMP3b與TGF-β的連結。結論是GDF10/BMP3b可以結合TGF-β的第一型與第二型受體TGFBR1-TGFBR2及活化MEK-ERK途徑來拮抗TGF-β誘導EMT的功能,然後藉TGFBR3以SMAD2/3相關的訊息路徑誘導GDF10/BMP3b的生成來進一步抑制EMT(圖1)。
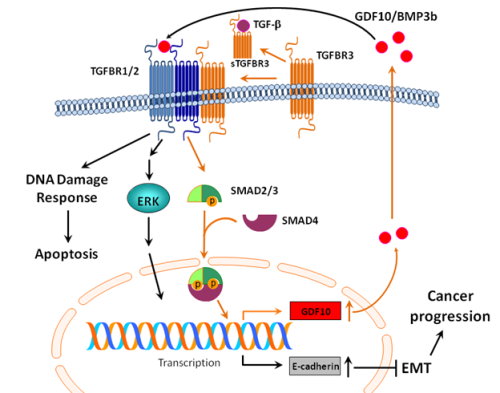
圖1:GDF10/BMP3b和TGFBR3抑制口腔癌細胞生長及表皮—間質細胞轉型(EMT)之角色
總結,李博士研究團隊發現可抑制口腔癌細胞生長及EMT之新細胞激素GDF10/BMP3b抑癌因子。從分子層次分析顯示,GDF10/BMP3b可拮抗TGF-β的訊息傳導功能來抑制癌細胞的生長與EMT,在癌症發展中扮演著抑制及煞車的角色。從臨床應用觀點來看,GDF10/BMP3b的表現高低則可用來作為口腔癌預後存活率的獨立生物標記;GDF10/BMP3b的增加可降低維他命A酸抗性以及增加化療藥物喜樹鹼(camptothecin)的敏感度(圖1)。對於口腔癌治療或化學預防,活化TGFBR3-GDF10訊息傳導將是組合治療應用很好的標靶對象。以上成果已發表於今年5月份Molecular Carcinogenesis期刊。
《文/圖:癌症研究所李岳倫副研究員》