NHRI Communications

研究發展
氫鍵網路對於吲哚胺2,3-雙加氧酶(IDO1)抑制劑設計的重要性
NHRI researcher reports the importance of hydrogen bond networks in indoleamine 2,3-dioxygenase 1 ( IDO1) inhibitor design
 癌症免疫療法是促進患者免疫功能,進而啟動攻擊機制,達到殺死癌細胞的目的。最近,癌症免疫療法有許多新的突破,為癌症患者帶來一線生機。Indoleamine 2,3-dioxygenase 1(IDO1)在免疫治療上是一個重要的藥物標靶,它是透過催化色胺酸(tryptophan)代謝來調控T細胞的免疫反應。目前也有許多研究是以IDO為分子標靶,進行新藥開發。在小分子抑制劑領域中,目前發展最前端的是Incyte公司研發的Epacadostat(INCB24360),已進入臨床試驗第III期,結果顯示其可強化T淋巴球(T lymphocyte)、樹狀細胞(dendritic cell)及自然殺手細胞(natural killer T cells)的反應。Epacadostat與許多免疫療法的生物藥或激酶抑制劑合併使用,對於治療惡性或轉移的腫瘤方面具有優越的抑制成效,並已進入臨床研究階段。除了Epacadostat,Newlink公司研發後技轉給基因泰克(Genetech)公司的IDO1抑制劑GDC-0919,不論是在酵素或細胞活性的抑制方面,也顯示具有極佳的抑制效果,目前已進入臨床試驗第I期,用於治療復發的晚期癌症的固體性腫瘤(recurrent advanced solid tumor)。
癌症免疫療法是促進患者免疫功能,進而啟動攻擊機制,達到殺死癌細胞的目的。最近,癌症免疫療法有許多新的突破,為癌症患者帶來一線生機。Indoleamine 2,3-dioxygenase 1(IDO1)在免疫治療上是一個重要的藥物標靶,它是透過催化色胺酸(tryptophan)代謝來調控T細胞的免疫反應。目前也有許多研究是以IDO為分子標靶,進行新藥開發。在小分子抑制劑領域中,目前發展最前端的是Incyte公司研發的Epacadostat(INCB24360),已進入臨床試驗第III期,結果顯示其可強化T淋巴球(T lymphocyte)、樹狀細胞(dendritic cell)及自然殺手細胞(natural killer T cells)的反應。Epacadostat與許多免疫療法的生物藥或激酶抑制劑合併使用,對於治療惡性或轉移的腫瘤方面具有優越的抑制成效,並已進入臨床研究階段。除了Epacadostat,Newlink公司研發後技轉給基因泰克(Genetech)公司的IDO1抑制劑GDC-0919,不論是在酵素或細胞活性的抑制方面,也顯示具有極佳的抑制效果,目前已進入臨床試驗第I期,用於治療復發的晚期癌症的固體性腫瘤(recurrent advanced solid tumor)。雖然許多IDO1抑制劑的相關研究已陸續進行並發表,但IDO1與小分子化合物結合的蛋白質晶體結構的報導目前並不多見。最早是2006年由Sugimoto等人發表了IDO1與氰化物(cyanide)及IDO1與4-phenylimidazole(抑制活性IC50 = 48 μM)結合的蛋白質晶體結構,之後在2014年Tojo等人發表IDO1與thiazolotriazole化合物(IC50 = 3.0 μM)及與imidazothiazole 化合物(IC50 = 1.9 μM)結合的晶體結構,提供不同類型的藥物作用模型。這些蛋白質結構的發表,幫助瞭解小分子化合物與IDO1蛋白的作用機制及與活性區域(active site)周遭胺基酸結合的立體空間位置,希望提供後續藥物設計的依據。不過,這些IDO1與小分子化合物結合的蛋白質結構具有解析度低或小分子化合物活性不佳的問題。
本院生技與藥物研究所伍素瑩研究員及其研究團隊,改良了IDO1蛋白質純化的方式並收集具同質性(homogeneous)的蛋白質,濃縮到超高飽和的濃度後,篩選了數百到數千個條件,找到IDO1蛋白質晶體形成的最佳條件,克服了IDO1蛋白質不易結晶的問題,成功解出數個IDO與抑制劑結合的高解析度共晶體結構(圖1);其中IDO1與化合物1的蛋白質晶體結構特別有趣。化合物1是進入臨床試驗第I期的GDC-0919之相似物,具有良好的酵素及細胞抑制活性(IC50 = 61 nM, EC50 = 200 nM)。由蛋白質結構顯示,化合物1利用環上的氮原子與蛋白質中血基質上的三價鐵,形成配位共價鍵結(圖2)。有趣的是,伍博士研究團隊觀察到化合物1與IDO蛋白質及血基質間形成多個重要的氫鍵作用力。其中,化合物1除了與血基質的propionate group形成分子間氫鍵之外,本身亦形成分子內氫鍵,而血基質與蛋白質間也形成分子間氫鍵。此特殊且重要的氫鍵網路(hydrogen bond networks)的作用力,在化合物1對IDO1蛋白質的抑制活性中扮演重要的角色。同時,由共晶體結構中,研究團隊也觀察到化合物1與周圍的胺基酸分子,例如Phe163、Arg231、Ala264與Val130形成很強的疏水性力量。

圖1:(A)化合物1與IDO蛋白質複合物的晶體;(B)化合物1與IDO蛋白質複合物結構(解析度為2.2Å)的電子密度圖(density map)
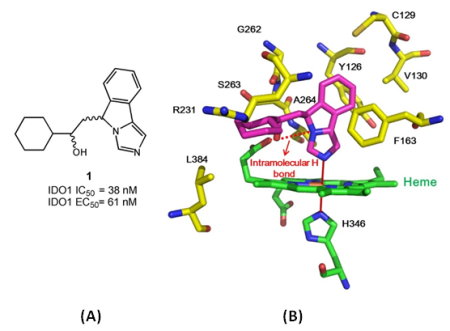
圖2:(A)化合物1的化學結構、生物活性及(B)化合物1(桃紅色)與IDO蛋白質(黃色為IDO蛋白質,綠色為血基質)的立體結構與之間的交互作用力
除了化合物 1,伍博士研究團隊也解出數個與化合物1化學結構相似但活性不同的類似物(analogues)和IDO蛋白質結合的結構(圖3),藉以瞭解這些化合物的化學結構與 IDO1活性上的關係(structure-activity relationship)。同時,此研究還利用UV-VIS光譜分析IDO1蛋白質與化合物結合的模式,區分晶體形成的條件(圖4)。
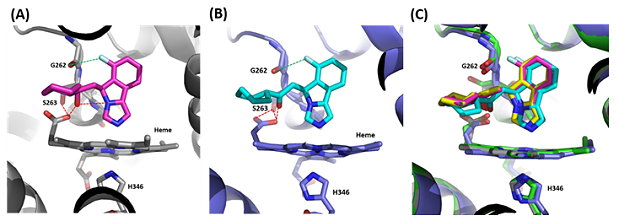
圖3:(A)化合物2(IC50 = 19 nM)(桃紅色)與IDO1蛋白質的立體結構。與化合物1相比較,化合物2因為額外與IDO1蛋白質形成鹵素鍵(halogen bond)而倍增抑制IDO1蛋白質的活性;(B)化合物3(IC50 = 279 nM)(淺藍色)與IDO1 蛋白質的立體結構。與化合物1相比較,化合物 3因為本身結構的關係而失去內氫鍵,因而失去重要的化合物與蛋白質間重要的氫鍵網路作用力,而降低抑制 IDO1蛋白質的活性;(C)將化合物1(黃色)、2、3的IDO1蛋白質的立體結構相重疊,顯示結構上的差異
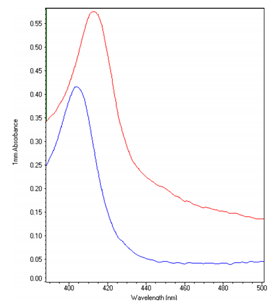
圖4:IDO1蛋白質光譜(藍線)與2 mM化合物1混合後(紅線)所產的訊號位移。Soret peak從波長403 nm位移至413 nm,往紅光位移,為化合物上的氮與血基質上的鐵結合的訊號
上述結果都增進了對IDO抑制劑與IDO蛋白質間原子之交互作用的深入瞭解,可提供後續藥物設計的方向及依據,並加速IDO抑制劑的藥物研發。此結果也發表在Journal of Medicinal Chemistry (2016;59:282-293 )。
《文/圖:生技與藥物研究所彭懿慧博士後研究員、伍素瑩研究員》