NHRI Communications

研究發展
節拍式化學治療減緩對腫瘤基質細胞與癌症幹細胞的刺激的新機制
NHRI researcher reports new mechanisms of metronomic chemotherapy revealing an attenuated stimulation of stromal fibroblasts and cancer stem cells
 僅管在最近十餘年來,新穎的標靶治療與免疫療法製劑不斷地出現,傳統化學治療目前仍為大部分癌症的主要或是唯一的治療方式。由過去半世紀所累積的科學研究與臨床經驗發現,第一線的化學治療雖然可以抑制部分腫瘤的生長,其效果往往是暫時性的;在治療後殘存的癌細胞會在數年後甚至快如數週後重新生長,造成癌症的復發與轉移,這是患者死亡的主要原因。由於第二線或是第三線的化學治療對於復發癌症的抑制功效十分有限,因此尋求降低化學治療後疾病復發的新途徑,乃是目前癌症治療上亟待解決的重要課題之一。
僅管在最近十餘年來,新穎的標靶治療與免疫療法製劑不斷地出現,傳統化學治療目前仍為大部分癌症的主要或是唯一的治療方式。由過去半世紀所累積的科學研究與臨床經驗發現,第一線的化學治療雖然可以抑制部分腫瘤的生長,其效果往往是暫時性的;在治療後殘存的癌細胞會在數年後甚至快如數週後重新生長,造成癌症的復發與轉移,這是患者死亡的主要原因。由於第二線或是第三線的化學治療對於復發癌症的抑制功效十分有限,因此尋求降低化學治療後疾病復發的新途徑,乃是目前癌症治療上亟待解決的重要課題之一。本院癌症研究所蔡坤志副研究員級主治醫師指導萬芳醫院消化腫瘤科張智翔醫師與美國加州大學舊金山分校組成的跨國研究團隊協同研究,利用先進的擬人化免疫小鼠(humanized mice)以及患者來源腫瘤轉殖技術(patient-derived tumor xenografts)領先世界發現,現行依據患者最高忍受劑量所設定的化學治療療法,會在高度纖維化的癌症(desmoplastic cancer),包括某些乳癌與胰臟癌的基質(stroma)中活化癌相關成纖維細胞(cancer-associated fibroblasts)中的STAT-1與NF-κB訊息傳導路徑,使其表達並分泌大量的ELR陽性驅化素(ELR-motif-positive chemokines),這些分泌激素會刺激殘存的腫瘤細胞,並將之轉化為具有高度侵犯性與抗藥性的所謂癌症幹細胞(cancer stem cell),同時刺激腫瘤微細血管增生(angiogenesis),並誘導具有免疫抑制能力的腫瘤相關巨噬細胞(tumor-associated macrophages)進入腫瘤基質,因而造成化學治療後癌症的復發以及轉移。
為避免此種化學治療的缺點,研究團隊發現若將化學治療藥物改以每天低劑量投予的「節拍式化學治療(low-dose metronomic (LCM) chemotherapy)」,可以大幅減少化學治療對癌相關成纖維細胞的刺激,避免其大量分泌ELR陽性驅化素,因此可避免傳統化學治療後癌症幹細胞的增加、血管新生以巨噬細胞浸潤的現象。研究團隊利用一系列具有高度臨床相關性的乳癌與胰臟癌動物模式研究證明,在相同的總暴露量(overall dose)之下,低劑量節拍式化學治療較傳統最高忍受劑量化學治療能顯著使腫瘤的生長與轉移受到有效抑制,同時更能明顯地延長治療後癌症宿主的存活期。此突破性的發現,於2016年12月刊登國際頂尖的《實驗醫學期刊(Journal of Experimental Medicine)》,同時由世界知名的腫瘤血管新生與節拍式化學治療先驅,加拿大多倫多大學Robert Kerbel教授撰寫專文介紹。美國洛克斐勒大學出版社並同時發布新聞稿宣布此突破性的發現,陸續更有超過二十多家國際媒體報導。
事實上,有關節拍式化學治療的概念以及其優越性,美國與加拿大的學者已於15年前提出。藉助於目前口服化學治療藥物以及奈米製劑包裹藥物製程的進步,此概念在臨床上應用的可行性逐步提升,例如,最近刊登在國際知名的《刺胳針(Lancet)》期刊上的臨床試驗證實,低劑量節拍式化學治療可以延緩大腸癌患者的復發,在第一線化學治療後疾病復發的時間由平均8.5個月延緩至11.7個月;而目前健保給付的5-氟尿嘧啶(5-fluorouracil)衍生的口服藥物也已經應用於胰臟癌、胃癌與大腸癌的治療上。預計在接下來數年內將有愈來愈多符合節拍式化學治療概念的癌症治療療法上市。研究團隊目前進一步研究低劑量節拍式化學治療對於其他種類腫瘤基質細胞與免疫細胞的有利影響,希望能夠找出其在臨床應用上更完整而強力的學理依據;同時更尋求結合低劑量節拍式化學治療與目前最熱門的癌症免疫療法的最適組合,以其能夠改善纖維化癌症治療的效果,造福更多癌症患者。
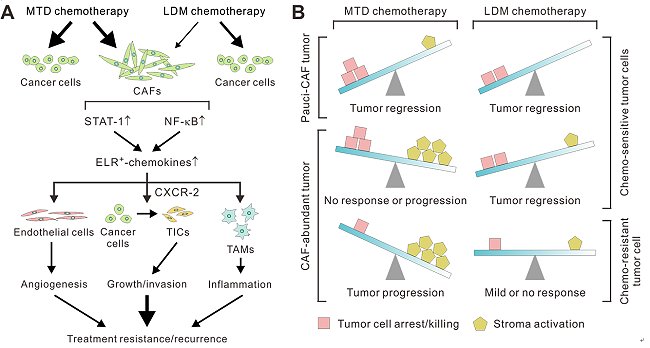
圖:(A)分子與細胞機制顯示,傳統最高忍受劑量化學治療療法(MTD)造成癌相關成纖維細胞活化,進而刺激腫瘤血管增生、癌症幹細胞生成與腫瘤相關巨噬細胞浸潤,最終造成治療抗藥性與腫瘤在治療後的復發;而低劑量節拍式化學治療(LCM)則可以大幅減少上述不利的基質反應。(B)癌症化學治療的效果被數個相互競爭的因子,包括腫瘤基質的多寡、癌細胞對化學治療藥劑的敏感度,以及化學治療的給予劑量與週期所共同決定。
《文/圖:癌症研究所蔡坤志副研究員級主治醫師》