NHRI Communications

研究發展
前列腺癌代謝過程的重要角色KDM4A應為治療之重要標的
NHRI researcher reports KDM4A coactivates E2F1 to regulate PDK-dependent metabolic switch between mitochondrial oxidation and glycolysis
 腫瘤代謝在近期的癌症研究上獲得越來越多的關注。癌細胞有一個重要特性稱作「Warburg效應(Warburg effect)」,其主要透過醣解(glycolysis)作用獲得能量,並製造大分子用以維持癌細胞快速增殖(過程詳如圖A)。組蛋白賴氨酸甲基化(histone lysine methylation)經常參與轉錄調節,組蛋白賴氨酸脫甲基酶(histone lysine demethylase, KDM)是從賴氨酸殘基去除甲基的特異性催化酶。自第一個KDM發現至今,已知有許多KDM在不同癌症中有遺傳上的改變或異常的表現;因此,KDM被認為是抗癌治療策略的研究方向。在許多癌症類型中,如同其他KDM4家庭成員,KDM4A被認為是基因活化或抑制的轉錄調節因子,包括前列腺癌、乳腺癌、肺癌和結腸癌的過度表達,是細胞增殖的關鍵。有鑒於此,本院分子與基因醫學研究所特聘研究員龔行健院士研究團隊先前的研究曾提出,以小分子抑製劑NSC636819選擇性抑制KDM4A/4B,對前列腺癌細胞LNCaP有顯著生長延緩及增加細胞凋亡的效果(Journal of Medicinal Chemistry 2014 Jul;57(14):5975-5985)。
腫瘤代謝在近期的癌症研究上獲得越來越多的關注。癌細胞有一個重要特性稱作「Warburg效應(Warburg effect)」,其主要透過醣解(glycolysis)作用獲得能量,並製造大分子用以維持癌細胞快速增殖(過程詳如圖A)。組蛋白賴氨酸甲基化(histone lysine methylation)經常參與轉錄調節,組蛋白賴氨酸脫甲基酶(histone lysine demethylase, KDM)是從賴氨酸殘基去除甲基的特異性催化酶。自第一個KDM發現至今,已知有許多KDM在不同癌症中有遺傳上的改變或異常的表現;因此,KDM被認為是抗癌治療策略的研究方向。在許多癌症類型中,如同其他KDM4家庭成員,KDM4A被認為是基因活化或抑制的轉錄調節因子,包括前列腺癌、乳腺癌、肺癌和結腸癌的過度表達,是細胞增殖的關鍵。有鑒於此,本院分子與基因醫學研究所特聘研究員龔行健院士研究團隊先前的研究曾提出,以小分子抑製劑NSC636819選擇性抑制KDM4A/4B,對前列腺癌細胞LNCaP有顯著生長延緩及增加細胞凋亡的效果(Journal of Medicinal Chemistry 2014 Jul;57(14):5975-5985)。另一方面,E2F1被認為是視網膜母細胞瘤蛋白(retinoblastoma protein, Rb)發揮作用的夥伴,且是許多細胞週期基因的轉錄活化生長調節的關鍵因素,許多有力的證據闡明E2F1與去勢抗性前列腺癌(castration-resistant prostate cancer, CRPC)的發展有關,然而作用機制尚不清楚。
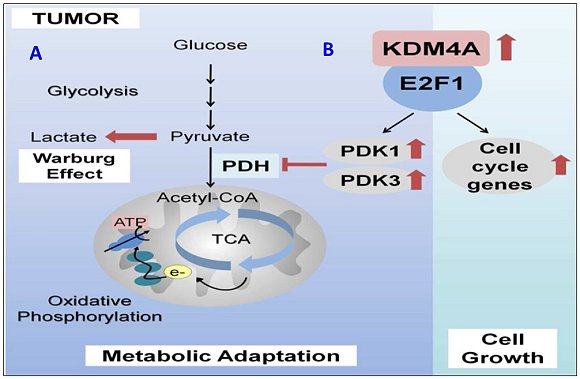
圖A:癌細胞轉換經醣解代謝而生成的丙酮酸(pyruvate),避免其進入粒線體的三羧酸(TCA)循環,抑制氧化磷酸化(oxidative phosphorylation)進行,從而抑制活性氧(ROS)的過度產生和防止粒線體驅動的癌細胞凋亡。丙酮酸脫氫酶激酶(pyruvate dehydrogenase kinase, PDK)是控制細胞中的丙酮酸傾向乳酸(lactate)或乙酰輔酶A(acetyl-CoA)流動的關鍵守門員之一;PDK對丙酮酸脫氫酶(pyruvate dehydrogenase, PDH)進行負調控,進而減少丙酮酸轉化為acetyl-CoA,從而限制丙酮酸對氧化代謝的利用。圖B:KDM4A共同活化E2F1以調節PDK依賴性的粒線體氧化和醣解作用之間的代謝轉換。
因此,龔院士研究團隊進一步探討與前列腺癌有重要關聯的KDM4A及E2F1之作用機轉(圖B),提出在前列腺癌代謝過程中,KDM4A為E2F1的輔活因子,並證明E2F1-KDM4A複合物在腫瘤代謝的控制中的功能作用。KDM4A及E2F1與目標基因啟動子結合,藉此增強E2F1的染色質結合力和轉錄活性,從而調節癌細胞增殖和存活所必需的轉錄型態。而PDK1和PDK3是KDM4A和E2F1的直接標靶,並且調節醣解代謝和粒線體氧化之間的轉換;KDM4A的減少導致PDH及粒線體氧化的活性提升,而造成活性氧過度的累積。經改變的代謝表型可經由KDM4A依賴性的調控,來調整PDK1和PDK3的異位表達(ectopic expression)而獲得部分恢復。
此研究發現KDM4A為E2F1的共同活化因子,且KDM4A-E2F複合物藉由正向調控PDK1和PDK3來調整代謝,從而促進氧化磷酸化導向醣解代謝的轉換,以加強前列腺癌細胞增殖和存活優勢。整體研究揭示KDM4A在前列腺癌代謝過程中扮演重要角色,並且為治療之重要標的,此研究成果已發表於國際期刊Cell Reports 2016 Sep 13;16(11):3016-3027。
《文/圖:分子與基因醫學研究所龔行健特聘研究員》