NHRI Communications

研究發展
抑癌新策略:標靶MCT-1相關之癌症代謝路徑
A novel anti-cancer stratagem: Targeting MCT-1-YY1-EGFR-MnSOD signaling network that regulates the cancer metabolism
 三重陰性乳腺癌是一種難以預期診斷且極具高侵犯性之乳腺癌,大多數三重陰性乳腺癌發生癌症轉移及復發的機率甚高,目前的荷爾蒙療法、HER-2標靶藥物及放射療法對三重陰性乳腺癌患者皆不適用,且無顯著的治療效果;因此,急需新的系統性醫療法。本院分子與基因醫學研究所徐欣伶副研究員對致癌基因MCT-1(multiple copies in T-cell malignancy 1)有前瞻性且深入的研究。徐博士的研究已證明MCT-1基因及其蛋白高度表達於各類型乳腺及肺腺癌細胞及臨床檢體中,提升MCT-1蛋白表現量能促進乳腺及肺腺癌細胞之異種移植腫瘤生長。徐博士研究團隊發現,透過抑制MCT-1蛋白表現量,會抑制三重陰性乳腺癌細胞之Src-p190B訊息傳遞活性,也顯著降低染色體套數異常增殖及細胞核體變異機率。最為重要的發現是,剔除MCT-1的致癌性可以有效地消除三重陰性乳腺癌細胞及腫瘤之增生,推測MCT-1致癌基因能運用至治療三重陰性乳腺癌或其它癌症之標靶分子(發表於Wu et al., Oncogene 2014 Oct 23;33(43):5109-20)。
三重陰性乳腺癌是一種難以預期診斷且極具高侵犯性之乳腺癌,大多數三重陰性乳腺癌發生癌症轉移及復發的機率甚高,目前的荷爾蒙療法、HER-2標靶藥物及放射療法對三重陰性乳腺癌患者皆不適用,且無顯著的治療效果;因此,急需新的系統性醫療法。本院分子與基因醫學研究所徐欣伶副研究員對致癌基因MCT-1(multiple copies in T-cell malignancy 1)有前瞻性且深入的研究。徐博士的研究已證明MCT-1基因及其蛋白高度表達於各類型乳腺及肺腺癌細胞及臨床檢體中,提升MCT-1蛋白表現量能促進乳腺及肺腺癌細胞之異種移植腫瘤生長。徐博士研究團隊發現,透過抑制MCT-1蛋白表現量,會抑制三重陰性乳腺癌細胞之Src-p190B訊息傳遞活性,也顯著降低染色體套數異常增殖及細胞核體變異機率。最為重要的發現是,剔除MCT-1的致癌性可以有效地消除三重陰性乳腺癌細胞及腫瘤之增生,推測MCT-1致癌基因能運用至治療三重陰性乳腺癌或其它癌症之標靶分子(發表於Wu et al., Oncogene 2014 Oct 23;33(43):5109-20)。徐博士研究團隊也發現,MCT-1會降低p53及PTEN蛋白的穩定度及功能活性。在致癌信息路徑中,MCT-1提升肺腺癌細胞EGFR活性和Shc蛋白之表現量,進而刺激Ras及ERK信息路徑(發表於Shih et al., Oncogene 2012; 401-415)。當EGFR磷酸化Shc,Shc與Grb2-Sos形成複合物,達到活化AKT、Ras、ERK及JNK信息效應。
標靶治療在某些癌症有顯著的療效,然而,許多標靶治療對正常細胞具有高毒性,並且大多數患者因基因突變或腫瘤異質性而產生復發。目前認為活性含氧物(reactive oxygen species, ROS)抑制劑結合阻止致癌路徑是一種低毒性的廣效性療法,可同時改變腫瘤微環境,並預防腫瘤轉移。
徐博士研究團隊進一步探討MCT-1的癌化活性是否會透過擴大表皮生長因子(EGFR)的信息傳遞鏈而產生ROS,結果發現,MCT-1-YY1-EGFR-MnSOD網絡有關的嶄新癌症代謝路徑,賦予對致癌細胞對過氧化物抗性,改變腫瘤微環境和增強腫瘤進展(發表於Tseng et al., Oncogenesis 2017;6:e313)。徐博士的新實驗結果證明:MCT-1透過YY1(Yin Yang 1, 一種普遍存在的轉錄因子)以及SP1能增強EGFR的表達。粒線體ROS過度地產生可能加速細胞癌化以及基因變異、擴張腫瘤發生的信號,並增加轉移潛能;而EGFR的過度表達或活化除了促進ROS產生、腫瘤進展和轉移,更促使癌細胞修復斷裂之DNA。因此,通過MCT-1和EGFR的共事效應反而增強癌細胞存活機率。
相反地,p53的表現會誘導microRNA-34a(miR-34a)去抑制YY1及EGFR所調控的癌化和轉移;因此,p53不足反而增強MCT-1-YY1-EGFR信息傳導並誘導MnSOD表達,藉此產生高量的ROS,導致基因突變及腫瘤之進展。
一般來說,細胞質內p53部分轉移到粒線體中,與MnSOD相互作用來控制粒線體ROS的量。然而,MCT-1可能透過抑制p53功能,導致細胞中的MnSOD和粒線體ROS上升並且活化AMPK,將癌細胞代謝方式轉化為糖酵解,來產生充分的生存能量(Warburg效應)。因此藉由MCT-1-YY1-EGFR網絡擴增MnSOD信號和粒線體過氧化物的形成,可以增強癌細胞增殖、侵襲和轉移的能力。反之,標靶MCT-1-YY1-EGFR-MnSOD信息傳導可有效抑制上述效應。徐博士的研究結果解析癌症代謝路徑,並且提出抑癌的新穎策略:透過阻止MCT-1-YY1-EGFR-MnSOD網絡,並結合抗氧化物,減少惡性腫瘤微環境之癌代謝及進展。這些研究結果闡明癌症形成之機轉,同時也提供未來癌症治療的新方向。
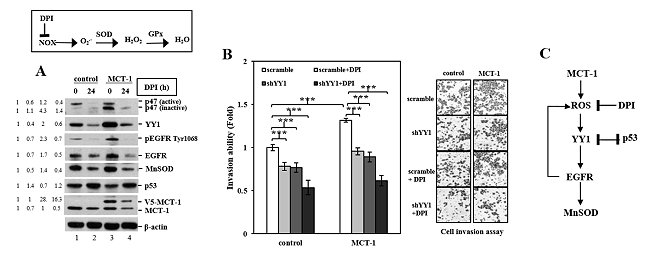
圖A:MCT-1過度表現造成p53不足和EGFR活化刺激,並誘導MnSOD的表現。圖B:利用ROS抑制劑(DPI)減低細胞中粒線體O2- 的產生並且減低YY1(shYY1)效應,更進一步地抑制癌細胞侵襲能力。圖C:透過調控MCT-1-YY1-EGFR-MnSOD機轉,同時抑制ROS異常產生(p53和DPI),可能改變癌化代謝途徑及重整腫瘤微環境。
《文/圖:分子與基因醫學研究所徐欣伶副研究員》