NHRI Communications

研究發展
長鏈非編碼RNA LncHIFCAR可望開發為口腔癌生物偵測標記與治療標靶
NHRI researcher reports long non-coding RNA LncHIFCAR is a HIF-1α co-activator and an oncogenic driver of oral carcinoma
 長久以來,腫瘤是醫師束手無策的棘手難題。目前已知「缺氧」是大多數腫瘤快速生長下的微環境特徵,更是引發癌細胞後續惡性化、抗藥性與轉移的重要原因。缺氧腫瘤不易治療且病患預後狀況較差,然而現今對於腫瘤缺氧反應之相關機轉並未完全明瞭。
長久以來,腫瘤是醫師束手無策的棘手難題。目前已知「缺氧」是大多數腫瘤快速生長下的微環境特徵,更是引發癌細胞後續惡性化、抗藥性與轉移的重要原因。缺氧腫瘤不易治療且病患預後狀況較差,然而現今對於腫瘤缺氧反應之相關機轉並未完全明瞭。口腔癌是全世界人類第五大癌症。在台灣,由於嚼食檳榔的特殊文化,口腔癌的發生率居高不下,排名十大癌症死因的第4位,同時也是發生率和死亡率成長最快的癌症之一。口腔癌不但常發生於青壯年時期,且男性發生率是女性九倍之多。近年來,罹患口腔癌之年齡層有逐年下降的趨勢,不僅是國人健康重大課題,更突顯出發展口腔癌早期診斷之生物指標以及有效治療之醫療策略的急迫性。包含口腔癌在內的許多腫瘤,常因快速生長導致氧氣供應不足,內部呈現缺氧狀態。缺氧是決定腫瘤惡性化發展的關鍵因素,近年來發現,腫瘤細胞在缺氧環境下,會激發「缺氧誘導因子-1α(Hypoxia-inducible factor-1α, HIF-1α)」的活性,HIF-1α進一步與許多轉錄輔助因子結合形成完整的HIF-1複合體,坐落於一系列相對應之缺氧反應基因上,進而啟動此一系列缺氧反應相關基因群之表現,以幫助腫瘤細胞於缺氧環境下存活,甚而促進癌細胞的轉移、惡化與抗藥性。因此,詳細瞭解腫瘤細胞調控缺氧反應的機轉是科學界與臨床醫學急切的課題。
長久以來,人們深信經由生物中心法則(central dogma;亦即DNA製造RNA,RNA製造蛋白質)製造出來的蛋白質是執行生物功能的基本單元;然而,近年來由於高通量DNA定序技術的快速發展而發現許多「非編碼RNA(non-coding RNA)」,其本身不具有編碼和轉譯成蛋白之能力,因此又被暱稱為生物學中的暗物質。長鏈非編碼RNA(lncRNA)即為其中之一大類,雖然種類眾多且數量龐大,然對其瞭解相當有限;目前越來越多的研究證據顯示,這些暗物質在基因表現調控與許多致病機轉上扮演關鍵角色。也因此,本院分子與基因醫學研究所龔行健特聘研究員與台北醫學大學(簡稱北醫大)施景文博士、柳營奇美醫院蔣維凡醫師共同組成之跨校跨領域研究團隊,結合基礎科學及臨床醫療研究,以長鏈非編碼RNA為研究主題,成功地發現缺氧誘發的長鏈非編碼RNA LncHIFCAR可作為HIF-1α的輔激活因子。此RNA分子在細胞遇到缺氧狀況時大量表現,並和HIF-1α直接結合,幫助聚集其他轉錄輔助因子而活化缺氧反應基因群的表現,進而幫助腫瘤細胞在缺氧環境中調整代謝途徑、有效存活、快速增生,並促進腫瘤侵襲與轉移,造成癌症惡化(圖1)。LncHIFCAR不但是目前首次發現具輔激活HIF-1α能力之長鏈非編碼RNA,更由於其可以利用患者血液進行偵測,因此具有高度臨床應用價值。
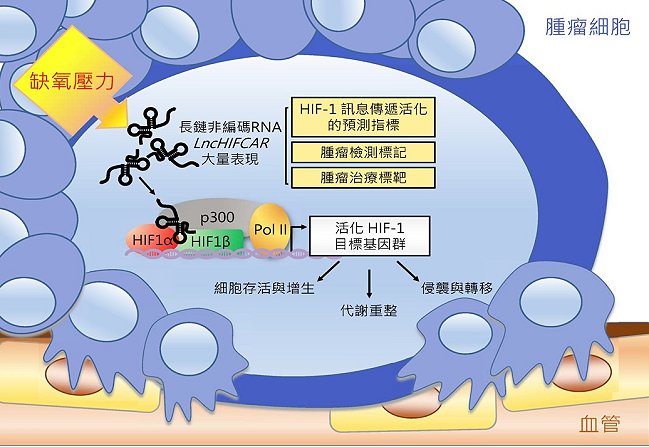
圖1:長鏈非編碼RNA LncHIFCAR與HIF-1訊息傳導在腫瘤形成與轉移過程所扮演之角色模型。於快速生長的腫瘤細胞中,缺氧所誘發的長鏈非編碼RNA LncHIFCAR,為HIF-1α的輔激活因子,藉由和HIF-1α的直接結合,LncHIFCAR可幫助聚集其他轉錄輔助因子以形成HIF-1轉錄複合物而活化缺氧反應相對應的HIF-1目標基因群的表現,進而幫助腫瘤細胞在缺氧環境中進行代謝重整、有效存活、快速增生,並促進腫瘤侵襲與轉移,造成癌症惡化
值得注意的是,研究團隊進一步對柳營奇美醫院所收集的國內口腔癌患者的組織樣本進行分析;結果發現,相對於周邊的正常組織,腫瘤組織內的LncHIFCAR有大量表現的趨勢。進一步對LncHIFCAR的表現分群,LncHIFCAR的表現量高的口腔癌患者其3年內的腫瘤復發存活率(disease-free survival rate)與整體存活率 (overall survival rate)均顯著較LncHIFCAR的表現量低的口腔癌患者為差(圖2)。生物統計分析更發現,LncHIFCAR的病理組織表現量可作為口腔癌患者腫瘤復發率的獨立預後指標,顯示LncHIFCAR的表現量於臨床診斷上的應用潛力。研究團隊更以動物模型進行試驗,分別將一般的口腔癌細胞株與降低LncHIFCAR表現的口腔癌細胞株經由尾部靜脈注射至小鼠體內。結果發現,降低LncHIFCAR表現的口腔癌細胞株轉移至小鼠肺部的能力顯著降低,進一步證實LncHIFCAR於腫瘤轉移的關鍵角色以及其作為癌症治療標靶的深厚潛力(圖3)。
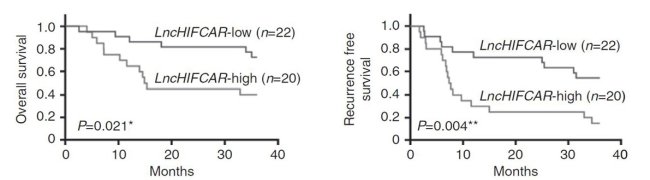
圖2:長鏈非編碼RNA LncHIFCAR表現量與42位口腔癌病人資料的追蹤分析
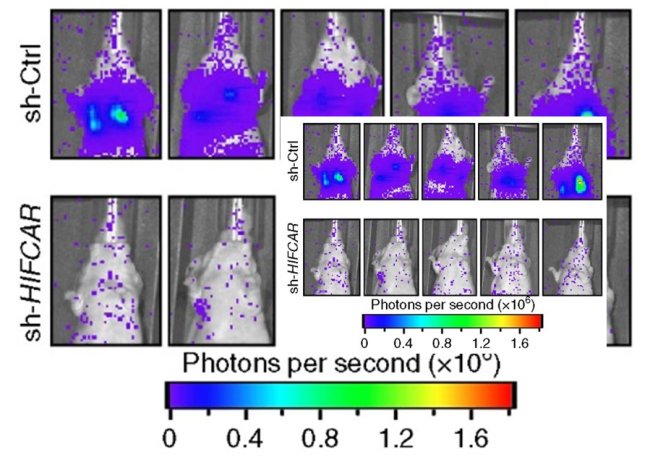
圖3:降低LncHIFCAR之表現能有效減少口腔癌細胞的肺轉移能力。分別將控制組的口腔癌細胞株(sh-Ctrl)與降低LncHIFCAR表現的口腔癌細胞株(sh-HIFCAR)經由尾部靜脈注射至小鼠體內。結果發現,降低LncHIFCAR表現的口腔癌細胞株轉移至小鼠肺部的能力顯著降低
此項研究由本院與北醫大、柳營奇美醫院共同合作而展現突破性成果,研究成果深受重視, 6月底已刊登於國際知名期刊《自然通訊(Nature Communications)》。近年來,以HIF-1α蛋白表現量作為預後根據與治療標靶的想法與策略遭受諸多困難與爭議,原因可能在於HIF-1α的整合性調節角色。不同於以往癌症研究著重於探討細胞蛋白或微小RNA相關之致癌機轉,此項研究突破性地發現細胞中之長鏈非編碼RNA與腫瘤缺氧反應有密切關連,不但再次證實這類RNA在調控基因表達的功能角色,更基於RNA本身的生化特性,聯合研究團隊所發現可作為HIF-1α的輔激活因子的長鏈非編碼RNA LncHIFCAR,可望設計成更為靈敏簡便之生物標記檢測套組,以作為早期篩檢或預測口腔癌惡化及轉移的基礎。此外,更可進一步設計及開發針對LncHIFCAR RNA專一性的阻斷性分子,透過微調LncHIFCAR RNA之表現量,作為針對具有高度惡化潛力口腔癌患者之精準治療方式。此項嶄新的分子指標不但能作為個人化癌症治療的有效策略,同時將提供未來口腔癌治療流程設計的依據,可望為國人的健康提供更多助益。
《文/圖:台北醫學大學施景文博士、柳營奇美醫院蔣維凡醫師及分子與基因醫學研究所龔行健特聘研究員》