NHRI Communications

研究發展
本院疫苗研發成果榮獲2017台北生技獎「技轉合作獎」銀獎
NHRI receives 2017 Taipei Biotech Technology Transfer Silver Medal Award
 腸病毒種類分為多種型別,總共有數十種以上,其中腸病毒71型及克沙奇病毒已被證實會引起5歲以下嬰幼兒手足口病、疱疹性咽峽炎和神經系統的病變甚至死亡,已在台灣、中國、東南亞多次爆發嚴重疫情。根據流行病學研究顯示,75%的手足口病是克沙奇病毒類感染,只有15%的手足口病是腸病毒71型所引起。而目前包括本院及其他國家(新加坡、中國等)開發的疫苗為使用福馬林去活化腸病毒71型疫苗(詳見備註說明),其臨床試驗結果皆顯示該疫苗只能預防腸病毒71型,對克沙奇病毒引起的手足口病無效;因此,在防治腸病毒感染引起之手足口病上,亟需要創新研發廣效性的新疫苗。
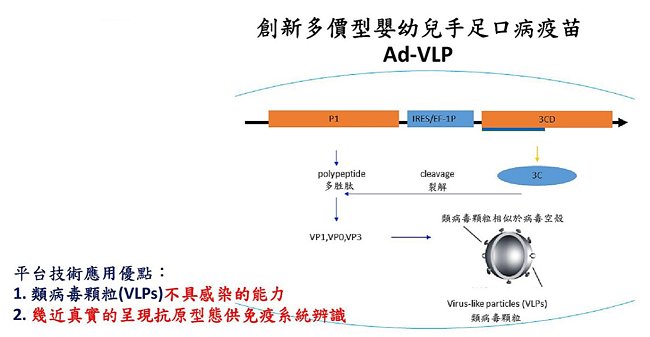
腸病毒種類分為多種型別,總共有數十種以上,其中腸病毒71型及克沙奇病毒已被證實會引起5歲以下嬰幼兒手足口病、疱疹性咽峽炎和神經系統的病變甚至死亡,已在台灣、中國、東南亞多次爆發嚴重疫情。根據流行病學研究顯示,75%的手足口病是克沙奇病毒類感染,只有15%的手足口病是腸病毒71型所引起。而目前包括本院及其他國家(新加坡、中國等)開發的疫苗為使用福馬林去活化腸病毒71型疫苗(詳見備註說明),其臨床試驗結果皆顯示該疫苗只能預防腸病毒71型,對克沙奇病毒引起的手足口病無效;因此,在防治腸病毒感染引起之手足口病上,亟需要創新研發廣效性的新疫苗。本院感染症與疫苗研究所周彥宏副研究員團隊,研發利用黏膜性載體(腺病毒載體Ad)攜帶並驅動腸病毒類病毒顆粒的基因,構築成Ad-VLP疫苗,且經動物實驗證實,可作為預防腸病毒及克沙奇病毒感染的多價型疫苗,並成功技轉聯亞生技開發股份有限公司(簡稱聯亞生技),由聯亞生技進行後續開發。藉由此技術建立之合作模式可加速產品開發上市時程,且適用於具有高度時效要求的新興傳染病疫苗研發,因此獲選2017台北生技獎「技轉合作獎」銀獎。
有別於過去減毒性腸病毒疫苗,Ad-VLP疫苗是一個新的技術平台,利用腺病毒載體攜帶不具毒性的腸病毒類病毒顆粒,並能幾近真實的呈現抗原型態供免疫系統辨識,引發正確的免疫保護作用。周博士研究團隊更運用其全球首創、符合人體病理反應的腸病毒感染實驗動物模式hSCARB2基因轉殖鼠進行試驗,準確測試Ad-VLP疫苗的效力。
周博士研究團隊發現,Ad-VLP疫苗可在受試老鼠體內表現類病毒顆粒(VLP),引起具有保護力的中和性抗體反應及Th1/Th2細胞性免疫反應,並且完全對抗腸病毒71型及克沙奇病毒A16型致死性攻毒,使受試動物完全存活。相較於福馬林去活化腸病毒71型疫苗只能引起中和性抗體反應,並只保護腸病毒71型的致死性攻毒,顯示出Ad-VLP疫苗為多價型疫苗,在通過臨床試驗後,可適用於嬰幼兒的接種,以遏止腸病毒71型或克沙奇病毒引起的手足口病。此技術除刊登在頂尖國際期刊PLoS Neglected Tropical Diseases(2015)外,同時更獲得2015年第12屆國家新創獎。
Ad-VLP疫苗在技術成熟度上已達試量產階段,並已建立所需的cGMP生產製程包含:(1)腺病毒載體生產之無血清,懸浮培養技術培養293A細胞;病毒純化製程;(2)疫苗生產用細胞庫生產及認證;(3)cGMP等級QC檢測QA文件鑑定及生產疫苗種原。在完成階段性臨床前開發工作後,於2016年7月成功技轉予聯亞生技,由其承接執行後續開發工作,希望藉由產學合作,加速產品研發時程,預計2018年開始進行臨床測試。
此技術平台有助於建立產官學三方合作模式,適用於新興傳染病疫苗研發,並結合其他病毒性疫苗開發多價疫苗用於嬰幼兒及全民感染症防疫。希望藉此帶動國內生技產業在新型疫苗的發展,協助提升國家防疫能量,將台灣生技產業推向國際水準。
備註說明:
目前主管機關核可之以「福馬林去活化」的疫苗均非常安全,因此以「福馬林去活化」的技術已廣泛用於病毒疫苗及細菌疫苗上,其中較為著名的包含已使用六十餘年之沙克疫苗與白喉百日咳破傷風三合一疫苗,以及每年施打的季節性流感疫苗,均是安全可靠的。福馬林與其他過敏原類似,僅極少數特異體質之敏感接種者,會因所含極低殘留量的福馬林(WHO規定須少於總量的0.01%,而國內所生產疫苗之殘留量更不到0.0001%)而產生過敏症狀,包含注射的部位產生紅腫或短暫肌肉痠痛等輕微副作用。
台灣現行生產疫苗藥廠皆須符合PIC/S GMP認證,且受「藥品查驗登記審查準則-疫苗類藥品之查驗登記」所規範,其標準比照歐美日等國,有非常嚴格的品質風險管控(QRM),能控管製造程序中所包含的設備、原料、生產製造、純化、包裝,以及後續的儲存、運輸、施打,都符合安全性、品質穩定的原則,且疫苗在上市前,亦須經臨床I期與II期試驗(Phase I & II clinical trials),嚴格檢視疫苗是否有安全性的疑慮。
《文:秘書室黃蕙嵐、感染症與疫苗研究所周彥宏副研究員;圖:技轉及育成中心、感染症與疫苗研究所周彥宏副研究員》