NHRI Communications

知識產權
新藥回歸正常—漫談2016年FDA核准小分子新藥(下) [註1和2]
Introduction to FDA approved novel small molecular drugs in 2016 (part 3)
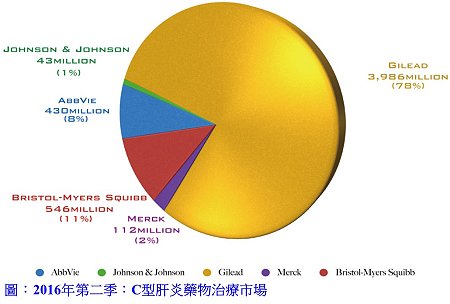 Gilead Sciences公司自2013年Sovaldi®核准上市後,開啟抗C型肝炎藥物新紀元,隨後又有多家藥廠(包括Gilead Sciences公司)推出不同的組合藥物,將整體C型肝炎藥物市場規模推上歷史高峰。從2016年第二季市場規模約為五十一億美元,其中Gilead Sciences公司以78%市占率遙遙領先其他競爭對手,Bristol-Myers Squibb公司以11%市占率居次,預估2016年全年C型肝炎藥物市場約為二百六十六億美元。接下來,本期介紹另外的2種感染性疾病藥物、2種中樞神經藥物及1種糖尿病藥物。
Gilead Sciences公司自2013年Sovaldi®核准上市後,開啟抗C型肝炎藥物新紀元,隨後又有多家藥廠(包括Gilead Sciences公司)推出不同的組合藥物,將整體C型肝炎藥物市場規模推上歷史高峰。從2016年第二季市場規模約為五十一億美元,其中Gilead Sciences公司以78%市占率遙遙領先其他競爭對手,Bristol-Myers Squibb公司以11%市占率居次,預估2016年全年C型肝炎藥物市場約為二百六十六億美元。接下來,本期介紹另外的2種感染性疾病藥物、2種中樞神經藥物及1種糖尿病藥物。感染性疾病藥物
(1) Epclusa® (Sofosbuvir/Velpatasvir)
 Gilead Sciences公司近三年來,每一年都有新藥獲美國FDA核准上市:2013年抗C型肝炎藥物Sovaldi®、2014年抗C型肝炎複方藥物Harvoni®以及2015年抗HIV藥物Genvoya®。Gilead Sciences公司在2016年6月28日再次獲得FDA核准用於治療C型肝炎的組合藥物—Epclusa®(NS5B抑制劑Sofosbuvir / NS5A抑制劑Velpatasvir;SOF/VEL;400 mg/100 mg),用於治療所有6種基因型的C型肝炎病毒。全世界預估有一千七百萬人受到C型肝炎感染,而在美國境內約有二百七十萬的感染人口,近75%為基因1型,20 ~ 25%為基因型2和3,其他基因型4 ~ 6相當少。台灣C肝患者約有五十至六十萬人,主要為基因型1b(66 - 71%)、2a(20%)和2b(10%)。FDA的核准是基於Epclusa®臨床III期研究結果:1,558位無肝硬化或輕度肝硬化受試者連續12週每天口服1次Epclusa®,有95%至99%受試者達到持續性病毒學反應(sustained virologic response, SVR12 = 95 - 99%)。另外,在一項有267位中度至重度肝硬化患者參與的試驗中,87名受試者在採用Epclusa®和ribavirin複方治療12週後,有94%患者血液中已偵測不到病毒。Epclusa®耐受性良好,最常見的副作用有頭痛和疲勞。
Gilead Sciences公司近三年來,每一年都有新藥獲美國FDA核准上市:2013年抗C型肝炎藥物Sovaldi®、2014年抗C型肝炎複方藥物Harvoni®以及2015年抗HIV藥物Genvoya®。Gilead Sciences公司在2016年6月28日再次獲得FDA核准用於治療C型肝炎的組合藥物—Epclusa®(NS5B抑制劑Sofosbuvir / NS5A抑制劑Velpatasvir;SOF/VEL;400 mg/100 mg),用於治療所有6種基因型的C型肝炎病毒。全世界預估有一千七百萬人受到C型肝炎感染,而在美國境內約有二百七十萬的感染人口,近75%為基因1型,20 ~ 25%為基因型2和3,其他基因型4 ~ 6相當少。台灣C肝患者約有五十至六十萬人,主要為基因型1b(66 - 71%)、2a(20%)和2b(10%)。FDA的核准是基於Epclusa®臨床III期研究結果:1,558位無肝硬化或輕度肝硬化受試者連續12週每天口服1次Epclusa®,有95%至99%受試者達到持續性病毒學反應(sustained virologic response, SVR12 = 95 - 99%)。另外,在一項有267位中度至重度肝硬化患者參與的試驗中,87名受試者在採用Epclusa®和ribavirin複方治療12週後,有94%患者血液中已偵測不到病毒。Epclusa®耐受性良好,最常見的副作用有頭痛和疲勞。新上市的Epclusa®在市場占有率該如何與Sovaldi®和Harvoni®區分?從治療角度分析,Sovaldi®主要用於基因型2和3 C肝患者,而Harvoni®則適用於基因型1和基因型4 ~ 6患者。美國已確診的270萬名C肝患者中,基因型1約占75%,故Harvoni®的銷售額占Gilead Sciences公司的C肝藥物總銷售額的70%。在基因型2和3 C肝治療市場上,由於此類型的C肝感染治療非常困難,目前最常見的治療藥物組合為Sovaldi® / ribavirin或Sovaldi® / Daklinza®(Bristol-Myers Squibb, BMS),每週期治療費用高達100,000美元,且副作用比較多,從而影響治癒率;Gilead Sciences公司欲利用Epclusa®衝擊基因型2和3的C型肝炎藥物市場,以相對便宜的價格(74,500美元卅12週),加上副作用低及效果好,未來或許很快就會成為基因型2和3 HCV感染患者的標準療法,有望成為超級重磅藥物。
Gilead Sciences公司的Sovaldi®和Harvoni®在2015年的銷售總額高達191億美元,二種空前成功的抗C型肝炎藥物已確立Gilead Sciences公司在該治療領域的絕對霸主地位(超過85%的市場占有率),唯一能對Gilead Sciences公司稍具威脅的只有AbbVie公司的Viekira Pak®,其療效與Harvoni®相比毫不遜色,但是由於每日1片卅2片組合的給藥不便性,導致其銷售遠遠落後於Harvoni®,2015年銷售額只有Gilead Sciences公司的十分之一(16.4億美元)。
值得一提的是,2016年12月15日Merck藥廠控告Gilead Sciences公司的Sovaldi®和Harvoni®專利侵權訴訟終獲勝利,美國德拉瓦州(Delaware)聯邦法院判Gilead Sciences公司支付Merck藥廠專利損害賠償金25.4億美元,創下美國史上第一高之侵權賠償數字。此專利大戰源於原專利權人義大利Degli Studi Di Cagliari大學在2005年和2009年分別將二項相關專利(US6,914,054和US7,608,597)轉讓給美國上市製藥公司Idenix Pharmaceuticals,但是當2013年Sovaldi®獲核准上市後,Idenix公司及Degli Studi Di Cagliari大學因認為該藥物侵犯了自己的專利,於是對Gilead Sciences公司提出侵權告訴,而2014年獲核准的Harvoni®因亦含有Sovaldi®有效成分,故於上市後,也被視為侵權產品。2014年6月9日,Merck藥廠以38.5億美元收購Idenix公司以進軍抗C肝藥物市場,於是本案即轉為Merck藥廠與Gilead Sciences公司的專利戰。
(2) Zepatier® (Grazoprevir/Elbasvir)
Merck藥廠汲汲於C型肝炎藥物的戰場,努力追趕下終於在2016年開花結果。繼Gilead Sciences 公司的Harvoni®與AbbVie公司的Viekira Pak®後, Merck藥廠的抗C型肝炎複方藥物Zepatier®(NS5A抑制劑Elbasvir / NS3C抑制劑Grazoprevir,50 mg/100 mg)於2016年1月28日以突破性藥物資格獲得FDA核准上市,其可合併ribavirin使用或單獨使用於基因型1和4(GT-1,GT-4)慢性C型肝炎病毒成人感染者的治療。Elbasvir(MK-8742)是NS5A抑制劑,而Grazoprevir(MK-5172)是第二代NS3/4A抑制劑。
FDA的核准是基於6個臨床研究,共1,373位基因型1和4慢性C型肝炎患者,使用Zepatier®進行為期12或16週試驗,主要終點以各治療組完成治療後12 週時的持續性病毒反應(SVR12)以判斷治療成功率,停止治療12週後若受試者HCV RNA水平低於定量下限,表示患者的C肝感染已經治癒。Zepatier®針對基因型1和4 C肝患者治癒率分別高達93%∼95%和94%∼100%。在基因型1 C型肝炎病毒感染的患者中,93%(483/519)在使用Zepatier®治療12週後完全治癒,而合併使用Zepatier® 與ribavirin的患者在治療16週後,有95%(55/58)獲得完全治癒。另外,基因型4 C型肝炎病毒感染的患者中,單獨使用Zepatier®完全治癒率達到94%(61/65),合併使用Zepatier® 與ribavirin的完全治癒率達到100%(8/8)。
目前Zepatier®除了在美國獲准上市外,亦已在歐盟、加拿大、日本、澳洲、沙烏地阿拉伯、以色列和瑞士上市。Merck藥廠對Zepatier® 之定價為5.46萬美元,相較於Harvoni®的9.45萬美元與Viekira Pak®的8.33萬美元,Zepatier®明顯有價格優勢,2020年預期年銷售額會達到15億美元,高峰年銷售額預計為20億美元。
中樞神經藥物
(1) Briviact®(Brivaracetam)
 2016年2月18日美國FDA核准由位於美國喬治亞州UCB公司(總部設於比利時布魯塞爾)開發的Briviact t®(brivaracetam,UCB-3471),用於治療16 歲以上患者局部型癲癇發作(partial-onset seizures)。癲癇發作(epileptic seizures)是指大腦突然發生短暫、可逆性之功能異常,造成暫時性神經症狀。當臨床上表現重覆性癲癇發作,即稱為癲癇,常見原因包括中風、感染、腫瘤、腦損傷和腦發育異常,屬於異常腦部活動,發作時間通常相對較短,常伴有不受控制移動、肌肉痙攣或意識喪失症狀。整體發病率為0.6∼1.1%,其中兒童癲癇發病率約為成人10∼15倍,約60%癲癇患者起病於兒童期,目前全球約有五千萬例癲癇患者,每年新增案例200萬例。在「癲癇發作之國際分類法」將癲癇發作依臨床現象與腦波變化分為三大類:第一類為局部型癲癇發作(focal or partial seizure),為局部性之腦波異常或病灶,臨床表現為單側或局部性之症狀;第二類為全身型癲癇發作(primary generalized seizure),患者大腦兩側同時呈現腦波異常,於發作開始時即喪失意識;第三類則屬於無法歸類上述兩類之癲癇發作。
2016年2月18日美國FDA核准由位於美國喬治亞州UCB公司(總部設於比利時布魯塞爾)開發的Briviact t®(brivaracetam,UCB-3471),用於治療16 歲以上患者局部型癲癇發作(partial-onset seizures)。癲癇發作(epileptic seizures)是指大腦突然發生短暫、可逆性之功能異常,造成暫時性神經症狀。當臨床上表現重覆性癲癇發作,即稱為癲癇,常見原因包括中風、感染、腫瘤、腦損傷和腦發育異常,屬於異常腦部活動,發作時間通常相對較短,常伴有不受控制移動、肌肉痙攣或意識喪失症狀。整體發病率為0.6∼1.1%,其中兒童癲癇發病率約為成人10∼15倍,約60%癲癇患者起病於兒童期,目前全球約有五千萬例癲癇患者,每年新增案例200萬例。在「癲癇發作之國際分類法」將癲癇發作依臨床現象與腦波變化分為三大類:第一類為局部型癲癇發作(focal or partial seizure),為局部性之腦波異常或病灶,臨床表現為單側或局部性之症狀;第二類為全身型癲癇發作(primary generalized seizure),患者大腦兩側同時呈現腦波異常,於發作開始時即喪失意識;第三類則屬於無法歸類上述兩類之癲癇發作。FDA是基於Briviact®的3項臨床試驗結果核准其上市,1,550位受試者同時服用Briviact®與其他藥物,結果顯示能有效地降低受試者癲癇發作的頻率。癲癇的治療以藥物治療最常見,由UCB公司開發的Keppra®(Levetiracetam)因可用於癲癇的單獨治療、不與其它抗癲癇藥物發生相互作用,且耐受性好等優點而成為一線藥物,其2008年全球銷售額就已突破20億美元。雖然Keppra®緩釋劑型(extended release)具專利保護至2028年,其一般劑型(immediate release)早已於2008年成為學名藥,而此次UBC公司開發的新一代抗癲癇藥物Briviact®,有別於目前的癲癇治療藥物,Briviact®不需要劑量調整,患者可就完整的治療劑量來幫助控制一天的癲癇發作,同時其對於作用靶點SV2A(synaptic vesicle glycoprotein 2A)的活性也比Keppra®強20倍,故未來有機會可以取代面臨專利到期的明星藥物Keppra®,成為新一代抗癲癇一線用藥。
(2) Nuplazid® (Pimavanserin)
 2016年4月29日FDA以突破性藥物資格和優先審查資格核准由Acadia Pharmaceuticals 公司開發的Nuplazid®(Pimavanserin,ACP-103),成為第一個治療帕金森(Parkinson’s disease)患者所產生幻覺(hallucination)和妄想(delusion)等精神症狀的藥物。全球大約有四百至六百萬帕金森患者,其中美國約有一百萬例,且每年新確診案例多達5萬例。50%的帕金森患者在患病期間有時會出現幻覺(看到或聽到不存在的事物)或妄想(出現錯誤信念)症狀,這些幻覺及妄想症狀的產生會導致患者出現傷害性的想法和情緒,從而影響其與親人的關係,甚至傷害到自己。Nuplazid®為高選擇性5-HT2A 反向促效劑(inverse agonist),其結合活性為ki值 0.087 nM,與5-HT2C 受體、5-HT2B 受體和dopamine受體的作用分別為0.44 nM、> 300 nM和 > 300 nM,因此沒有其它精神分裂藥物的不自主運動副作用。FDA核准Nuplazid®是基於關鍵性臨床III期Study-020結果,共有199位受試者接受Nuplazid®持續6週的臨床試驗治療。與使用安慰劑組相比,Nuplazid®大幅降低了幻覺及妄想症狀的發生頻率和(或)嚴重程度。
2016年4月29日FDA以突破性藥物資格和優先審查資格核准由Acadia Pharmaceuticals 公司開發的Nuplazid®(Pimavanserin,ACP-103),成為第一個治療帕金森(Parkinson’s disease)患者所產生幻覺(hallucination)和妄想(delusion)等精神症狀的藥物。全球大約有四百至六百萬帕金森患者,其中美國約有一百萬例,且每年新確診案例多達5萬例。50%的帕金森患者在患病期間有時會出現幻覺(看到或聽到不存在的事物)或妄想(出現錯誤信念)症狀,這些幻覺及妄想症狀的產生會導致患者出現傷害性的想法和情緒,從而影響其與親人的關係,甚至傷害到自己。Nuplazid®為高選擇性5-HT2A 反向促效劑(inverse agonist),其結合活性為ki值 0.087 nM,與5-HT2C 受體、5-HT2B 受體和dopamine受體的作用分別為0.44 nM、> 300 nM和 > 300 nM,因此沒有其它精神分裂藥物的不自主運動副作用。FDA核准Nuplazid®是基於關鍵性臨床III期Study-020結果,共有199位受試者接受Nuplazid®持續6週的臨床試驗治療。與使用安慰劑組相比,Nuplazid®大幅降低了幻覺及妄想症狀的發生頻率和(或)嚴重程度。Acadia Pharmaceuticals公司於1993年成立,總部位於美國聖地牙哥,是一家專注於中樞神經系統疾病的製藥公司,在90年代使用其自行開發且具有專利權的R-SAT(Receptor Selection and Amplification Technology)篩選平台,自130,000化合物資料庫中找到先導化合物,之後經過結構優化而成為Nuplazid®。Nuplazid®的核准上市過程並非一帆風順,在2009年9月3日曾面臨兩個關鍵臨床試驗:治療帕金森患者所產生精神症狀改善之臨床III期試驗(the treatment of Parkinson’s disease psychosis)及合併使用抗精神病藥物輔助治療精神分裂症病患之臨床II期試驗(adjunctive treatment of schizophrenia alongside an antipsychotic medication)因沒有達到主要終點而失敗,且唯一成功的III期臨床試驗,在91個使用Nuplazid®的患者中,雖有7人完全緩解,卻也造成5人發生嚴重不良反應,其中1人死亡的困境。此外,Nuplazid®有一個嚴重的副作用,即摔倒事件增加,這對年輕人來說可能不成問題,但對老年人來說,摔倒頻率上升可能進而導致骨折甚至內臟損傷,故不可不慎。另外,FDA專家諮詢委員會在2016年3月29日投票前曾質疑Nuplazid®在帕金森病的治療方面是否具有臨床意義,故特別要求Acadia Pharmaceuticals公司採取帕金森病陽性症狀評定量表(SAPS-PD)來評估新的臨床試驗結果,這是在過去審查過程中所沒有過的要求。總體而言,由於傳統治療精神分裂藥物的副作用大且多有不自主運動副作用,使得帕金森患者症狀雪上加霜;雖然Nuplazid®的治療效果有限,但是仍具有積極的臨床意義,與不斷調整常規用藥劑量來控制不自主震顫的症狀相比,最後FDA專家諮詢委員會以12票對2票建議通過Nuplazid®之上市。
對於小規模的Acadia Pharmaceuticals公司而言,當初兩個關鍵臨床試驗失敗,幾乎差一點讓公司關門大吉,股票最高達到過50美元,也曾跌破過1美元。原訂2015年3月11日要向FDA提交NDA申請,然而因為生產質量保證(quality assurance, QA)無法符合FDA之產品上市前查驗登記,以致推遲上市申請,同一天,Uli Hacksell 執行長也突然請職卻沒有官方解釋,結果導致股票大跌22%。Acadia Pharmaceuticals公司直到2015年9月3日才正式向FDA提出NDA正式申請,在2016年4月29日Nuplazid®獲得FDA核准上市的這一天,公司股票飆升了80%。Acadia Pharmaceuticals公司在2016年6月將Nuplazid®推向美國市場,售價估計為一萬三千五百美元卅年。Evaluate Pharma公司預計該藥在2020年的銷售額將達到8.41億美元,5年內將成為年銷10億美元的暢銷藥物,市場預計峰值銷售可達14億美元。目前Nuplazid®正針對精神分裂症和阿茲海默症患者常見的精神疾病進行II期試驗,如果成功,預計Nuplazid®銷售額可突破30億美元的大關。華爾街已將Acadia Pharmaceuticals公司列為大藥廠併購首要目標之一。
糖尿病藥物
(1) AdlyxinTM(Lixisenatide)
2016年7月28日FDA核准由法國Sanofi-Aventis藥廠開發的AdlyxinTM (Lixisenatide; Lyxumia;ZP10;AVE 0010)用於治療第2型糖尿病。AdlyxinTM屬於類升糖素胜肽-1受體促效劑(glucagon-like peptide-1 agonist, GLP-1 agonist),在此之前已有4個GLP-1促效劑獲FDA核准上市,分別是 AstraZenca公司的 Byetta®(2005年)/ Bydureon®(2012年)、Novo Nordisk公司的Victoza®(2010年)、GSK公司的Tanzeum®(2014年)和 2014年Eli Lilly公司的 Trulicity® (2014年)。AdlyxinTM是由44個胺基酸組成的胜肽(peptide)藥物,為美國西南部和墨西哥沙漠的希拉毒蜥(Gila monster)唾液中所發現的一個類荷爾蒙成分exendin-4衍生物。AdlyxinTM具有促進胰島素分泌和合成、抑制用餐後胰高血糖素釋放、延緩胃排空、改善β細胞功能並阻止其凋亡等多重作用,由此達到血糖控制效果。FDA指出美國至少有29萬例第2型糖尿病患者,占糖尿病病例的90%以上。如果不及時治療,持續的高血糖水平會導致嚴重的併發症,如心臟疾病或中風風險劇增、視網膜病變、腎衰竭、足部神經病變或截肢等嚴重後果。
FDA核准AdlyxinTM是基於10項臨床試驗安全性和有效性的結果,5,400名第2型糖尿病患者分別單獨施予AdlyxinTM,或是與metformin、sulfonylureas、pioglitazone或基礎胰島素合併使用,結果顯示AdlyxinTM僅須每日注射一次,就能有效降低患者的糖化血色素水準(HbA1c),且具有良好的耐受性。此外,在超過6,000名第2型糖尿病患者動脈粥狀硬化心血管疾病的風險評估結果指出,AdlyxinTM的使用並沒有增加這些患者心血管不良事件的風險。
AdlyxinTM是由丹麥Eva Steiness醫師卅博士創立於1998年的Zealand Pharma公司所自行開發的產品。Eva Steiness醫師卅博士原為哥本哈根大學臨床藥學教授,後於1989-1998年於H. Lundbeck公司擔任執行副總裁一職,並成功為H. Lundbeck公司開發兩項藥物上市。2003年6月25日Zealand Pharma公司將AdlyxinTM技轉給Aventis 公司(2004年Sanofi公司併購Aventis公司,改名為Sanofi-Aventis藥廠),由Aventis公司取得後續開發所有權利,並支付Zealand公司1千萬美元簽約金、1億美元里程碑金以及上市後銷售權利金。Sanofi-Aventis藥廠於2013年2月1日取得歐洲產品核准上市,並於2013年2月向美國FDA提交NDA申請案,經與FDA討論心血管安全性評估(2008年FDA新規定,所有糖尿病新藥申請NDA時,必須要提交心血管安全性評估資料)後,自願撤回NDA申請,直到2015年9月才重新叩關,並於2016年7月28日獲得FDA核准上市。AdlyxinTM在美國以外的商品名為Lyxumia®,共獲得全球40多個市場核准,包括大多數歐盟國家、日本、巴西、墨西哥和印度。
目前GLP-1市場的領導產品是Novo Nordisk公司開發的Victoza®,AstraZenca公司1週1次的Bydureon®居次,加上近兩年Eli Lilly 公司1週1次的Trulicity®強勢進場,因此嚴重壓縮AdlyxinTM市場穿透空間;市場佔有率空間有限,再加上AdlyxinTM專利即將於2020年到期,故早在2010年6月8日Sanofi-Aventis藥廠與Zealand公司即同意擴張2003年的合作合約,讓Sanofi-Aventis藥廠可以將其長效型胰島素Lantus®與AdlyxinTM合併使用,此產品Soliqua® 100/33(Lantus / Adlyxin)已於2016年11月21日核准上市。Sanofi-Aventis 藥廠目前比較著重於Soliqua® 100/33 複合針劑(Lantus/Adlyxin)之布局,主要目標在挑戰同一天獲FDA核准由Novo Nordisk公司開發的IDegLira複合針劑(Xultophy® 100/3.6, insulin degludec (Tresiba) / liraglutide (Victoza))。
[註1]新藥回歸正常—漫談2016年FDA核准小分子新藥(上),《國家衛生研究院電子報711期》。
[註2] 新藥回歸正常—漫談2016年FDA核准小分子新藥(中),《國家衛生研究院電子報712期》。
《文/圖:生技與藥物研究所謝興邦研究員、李靜琪副研究員》