NHRI Communications

會議報導
第25屆歐洲細胞科技(ESACT)雙年會紀實
Report on the 25th European Society for Animal Cell Technology
 本院感染症與疫苗研究所胡勇誌助研究員於2017年5月14日至17日前往瑞士洛桑聯邦理工學院(EPFL)參加第25屆歐洲細胞科技(ESACT)雙年會,會議主題為創新治療的細胞科技(cell technologies for innovative therapies)。 會議共有10個主題,包括:細胞科技市場新趨勢、最新細胞製造技術與發展、疫苗研發等議題,內容都與細胞科技發展有關,超過九百人員與會,這次台灣有筆者與生物技術開發中心二位研究人員參與此盛會。筆者有幸參與此次會議,並以「Development of suspension MDCK cells culture in chemically-defined medium for influenza virus production」為題展示壁報,推廣本院流感疫苗技術與最新研發成果,期望未來此技術能產業化。
本院感染症與疫苗研究所胡勇誌助研究員於2017年5月14日至17日前往瑞士洛桑聯邦理工學院(EPFL)參加第25屆歐洲細胞科技(ESACT)雙年會,會議主題為創新治療的細胞科技(cell technologies for innovative therapies)。 會議共有10個主題,包括:細胞科技市場新趨勢、最新細胞製造技術與發展、疫苗研發等議題,內容都與細胞科技發展有關,超過九百人員與會,這次台灣有筆者與生物技術開發中心二位研究人員參與此盛會。筆者有幸參與此次會議,並以「Development of suspension MDCK cells culture in chemically-defined medium for influenza virus production」為題展示壁報,推廣本院流感疫苗技術與最新研發成果,期望未來此技術能產業化。此次參與會議,針對生技產業製造的變化,總結如下:
一、細胞培養方式的改變(fed-batch to perfusion)
批式培養法(batch fermentation)指先將細胞和培養基一次性裝入反應器內進行培養,細胞不斷生長,同時產物也不斷形成,經過一段時間的培養後,終止培養。在細胞培養過程中,不會向培養系統補充任何營養物質,而只控制培養系統的含氧量、pH值、溫度。由於批式培養過程的環境隨時間變化很大,而且在培養的後期往往會出現營養成分缺乏或抑制性代謝物的積累使細胞難以生存,不能使細胞自始至終處於最優的條件下生長、代謝,因此在動物細胞培養過程中採用此法的效果通常不佳。饋料批式發酵法(fed-batch fermentation)即在發酵期間每隔一段時間補充新鮮培養液到發酵槽中,多年來生技產業都是以這種方式生產重要生物製劑藥,如抗體藥。好處是不需要複雜的饋料操作方式,培養過程中細胞成長可以得到較好的控制,確保其產出的大分子蛋白質藥的結構不會改變太多,這也是多年來法規單位較認可的生產模式。灌注連續式發酵法(perfusion fermentation)是發酵槽內設置細胞攔阻裝置,避免細胞隨著換液流出而流失,此種方法的特色是利用連續更換新鮮的培養基進入發酵槽內來提升槽內細胞生長濃度,進而達到高濃度蛋白藥從槽內釋出。這樣的培養方法,已在學術界使用多年,過去並沒有被產業廣泛的應用,第一個原因系統操作複雜需大量人力支應,第二原因是過去分析設備無法提供線上分析資料證明其連續收獲的大分子蛋白質的結構是否有一致性。近幾年隨著生產與生化分析設備的進步,已經有許多大藥廠開始以此種培養方法進行量產研究,甚至有些進展較快的藥廠,早已使用此方法生產大分子蛋白質藥。
二、蛋白藥的表現量還是過低(low protein expression)
目前市面上的生物製劑抗體藥大都靠中國倉鼠卵巢細胞(Chinese hamster ovary cells, CHO cells)生產,如果蛋白質的表現量能有2 – 5 g/L,就具有商業開發價值,但想要再往上提升蛋白質的表現量就有困難度。會議中,在Biogen 公司工作的Thomas Ryll 博士提到,過去產業界努力了二、三十年,只看到製造技術的提升,卻始終無法看到蛋白質表現量可以達到 10 – 20 g/L的水準 。從Ryll博士的觀點,說明了細胞科技在蛋白表現部分是還有許多進步的空間。
三、整合式連續製程(integrated continuous manufacturing)
早期的生物製劑的製程通常是一個步驟完成後才開始進行下一個步驟,也因如此,像下游製程所需時間較長及消耗大量純化所需的緩衝液(buffer)。由於分析設備的精進,使得法規單位對生物製藥產品的要求,漸漸趨於像3C產品的高品質方向要求,藥品的品質設計(quality by design, QbD)便是一個關注的焦點。傳統上藥品開發採用試誤法(trial & error),經由反覆測試與最終產品的檢驗(quality by testing),來得到合乎藥品規格的製程條件。但是對於原料、賦形劑、製造、包材等特性,或彼此間搭配特性,對品質的影響性較缺乏整體性的探討。因此,當出現異常品時或無法符合銷售市場的法規需求時,需再經由調查與測試來改善。製程分析技術(process analytical technology)技術就仰賴監控自動化設備的精進(例如線上即時細胞密度測定儀),使得過去對生物製劑產品品質控管(quality control)的容許誤差值更為縮小。也因此,最近幾年有研究學者開始將上、下游製程設備做系統性整合,作法是將過去非連續的單一步驟製程(unit operation),將每一個生產設備的連接串接在一起(如下圖所示),反應器的收穫液(harvest)透過自動化機器設備直接進入純化製程步驟,大幅縮短各個步驟間的處理等待時間。這樣的概念引起產業界興趣。這個概念的應用,需要得到法規單位對連續收穫生物製劑產品的品質與穩定度的認可,其中最重要的一部分就是醣基化(glycosylation)的穩定度,相信未來隨著線上分析儀器的進步,生物製劑產品的製造自動化指日可待。
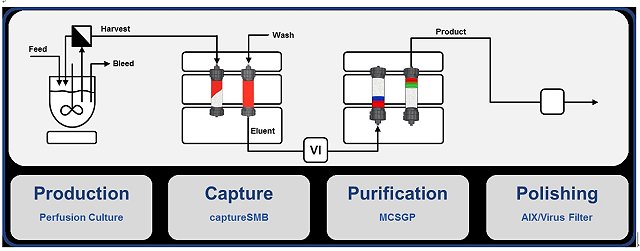
資料來源:取自Massimo Morbidelli教授於蘇黎世聯邦理工學院研究群官網
四、模組化生技製廠的設置
美國Amgen公司在會議中介紹該公司第一次在亞洲興建的模組化(modular)生物製劑廠,廠址設在新加坡西部郊區(Tuas Biomedical Park)。這個廠主要製造Prolia® 及XGEV 癌症藥,廠房從設計到施工完成不到兩年的時間,廠內部的生物反應器的規模最大到500 - 1000 公升。該公司目前將規劃興建第二個一模一樣廠房,用來製造其他生物製劑產品。這也讓筆者想到最近有關於三星生物製劑(Samsung Biologics)的新聞,三星總公司察覺3C微利時代到來,開始轉投資,發現生物製劑產品的毛利較高,公司於是在2011年成立生物製劑公司,共投資600億台幣,目標就是要成為亞洲最大的生物相似藥代工廠(CMO),公司也是利用模組化的概念設置3個廠,分別有30、150、180噸的產能,目前三星生物製劑是美國必治妥(Bristol-Myers)公司及瑞士羅氏藥廠(Roche)的合約製造廠。於去年12月開始斥資8,500億韓元(約二百五十五億台幣)興建第3廠,預計明年完成,屆時將成為世界最大規模的生物製劑合約製造廠。新廠落成後,三星預料年營業獲利將達1兆韓元。反觀台灣的大部份生技產業都朝新藥開發為主,是否能產業化的目標難以預測。三星集團以3C電子產業為主,卻有強大的企圖心進入門檻極高的生技產業,公司初創時期靠著收購幾家美國生技製劑藥廠的方式快速進入生技產業的門檻,由於生產線的規模大到足以壓低製造成本,使三星生物製劑公司漸漸成為全球生物製劑代工的領航者 。 由這些例子看來,先進模組化生物製劑廠房與創新的生產技術,足以讓「代工」為主的生技產業,創造出屬於自己的一片天空 。
《文/圖:感染症與疫苗研究所胡勇誌助研究員》