NHRI Communications

健康知識
微小生物的大時代—從腸道菌相看看您我的世界
The era of microbe: Understanding gut microbiota and you
 什麼是微生物相(microbiota)?什麼是微生物體(microbiome)?
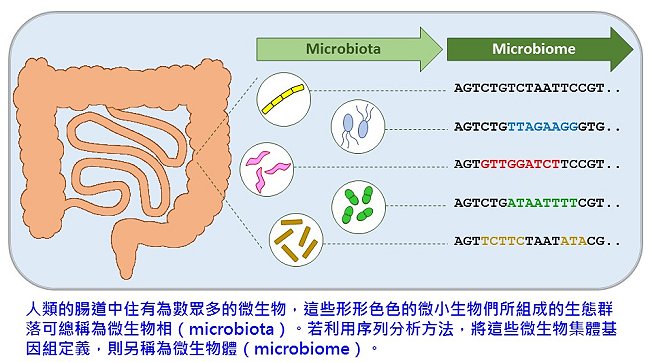
什麼是微生物相(microbiota)?什麼是微生物體(microbiome)?微生物相(microbiota)泛指「一群」棲息在植物或動物體內部與表層,或是環境中(例如土壤、深海、居住物等),肉眼看不見的微小生物。這些微小生物包括了細菌、真菌、病毒或原生生物,其與宿主之間發展出互利共生(symbiosis)、片利共生(commensalism)或致病(pathogenesis)關係。至少50年前,microbiota一詞即出現在生態學領域中,然而隨著人類疾病研究的演進與蓬勃,一般報章雜誌上的「microbiota」一詞越來越常指與人類相關的微生物相(human microbiota),甚至限縮於菌相而已(本文以下亦然)。另一方面,隨著分子生物學的巨大進展,科學家觀察微生物相的角度,從過往的培養盤篩選,得以從基因或從更細部的DNA序列進行分析。正由於體學(omics)的發展,微生物體(microbiome)一詞在2001年由微生物學家Joshua Lederberg(1958年諾貝爾獎生醫獎得主)建議使用;事實上,早在2001年之前就有「微生物體」一詞,但是直到2001年後才產生定義上的共識:凡是以「基因體」為角度論述微生物相即可稱為微生物體。無論如何,隨著高通量定序的效率和成本的大幅下降,以及蛋白質體學(proteomics)、代謝體學(metabolomics)或甚至表觀遺傳學(epigenomics)的應用,微生物相和微生物體研究爆炸性地展開,一個屬於微小生物的大時代,正式來臨。
為什麼腸道菌相很重要?與宿主人類如何相互作用?
試想有一群細胞,數量約1014(百兆級),約人體細胞總數1013(十兆級)的十倍之多,存在於您我的腸道之中,總重約有二公斤,您能忽略這群細胞的存在嗎?而這群細胞正是微生物們。過去的研究認為這些共生的微生物能在我們身體各部位形成聚落,讓其他致病菌無法坐落貼附,因而對我們有益。腸道可謂人體最大的免疫器官,腸道菌叢經由演化與人類的免疫系統有著密切的關係。近年來的研究更證實,這些腸道菌微生物們藉由它們的分泌蛋白或是代謝產物,直接或間接地影響我們的免疫系統或是更直接地殺死致病菌,間接地幫助我們對抗炎症、感染症與自體免疫。腸道菌叢也被發現能夠影響神經與大腦,進而改變動物行為或生理週期。腸—腦軸線(gut-brain axis)學說的興起近二十年,在導入了微生物相的概念後,已經進展成了菌—腸—腦軸線(microbiota-gut-brain axis)。最終,腸道菌叢能夠藉由上述的抗發炎、避免感染、改變免疫系統、行為和生理週期,控制宿主的生理代謝系統,包括攝食、消化、吸收和代謝等階段,都已證實受到腸道微生物影響,而微生物們則從中獲利,取得了它們所需的養分與棲地。
為什麼腸道菌相和疾病相關?
一般情況下,腸道微生物相在宿主中能夠達到穩定的動態平衡,然而,許多文獻指出,人類疾病的發生,往往與微生物相的3種變化相關。(1)生態失調(dysbiosis):當原本的微生物相因環境改變或刺激,發生了劇烈的變動,因而破壞了原本宿主—微生物之間的相互關係。一般常見的案例是抗生素的濫用,導致腸道菌的大量死亡。不完整的腸道菌相,無法幫助宿主完整地消化,合成維生素,也失去原有能夠抵抗致病菌的貼附防線,輕則影響養分吸收,重則導致腸炎;(2)伺機性感染(opportunistic infection):有一部分的微生物,雖然和宿主維持共生關係,但是在宿主免疫力較差的時候,可能具有感染能力,轉成致病細菌的角色;(3)不適切的代謝影響:腸道微生物能夠幫助宿主分解食物成代謝中間物,或是幫助合成維生素,再轉交給腸道上皮細胞讓宿主吸收。然而,越來越多文獻指出,某些代謝中間物可能引發或是抑制代謝性疾病,而問題的最終將會回歸到底是哪些種類的微生物產生特定的代謝物。若是對宿主代謝比較不好的微生物所占的比例較高,有可能造成宿主代謝性疾病。藉由上述的3種變化,我們同時也瞭解到,腸道微生物相的多樣性以及各菌種之間所占的比例,能夠與人類疾病產生關聯,而腸道微生物體研究的目的,正是為解開這些隱藏而未探知的線索。
大型微生物體研究計畫:
為了更加瞭解與人類相關的微生物相,許多大型的微生物體研究計畫在世界各地展開,簡介如下:
- 人類微生物體計畫(Human Microbiome Project)(https://hmpdacc.org/):
為了通盤瞭解人體內外有哪些微生物,美國國家衛生研究院(NIH)於2007年12月啟動第一階段(HMP1)5年期計畫,共300位受試者,以5個身體部位(鼻腔、口腔、皮膚、泌尿道、消化道,共15至18位點)分3次採樣,發現總共超過一萬種不同的菌種。2013∼2016年第二階段計畫(iHMP)也已經完成,其特點在於追蹤單一個體的長時間菌相,並且導入更多的體學分析,像是細菌的全基因體定序(whole genome sequencing)、轉錄基因體學(metatranscriptomics)、代謝體學卅脂質體學 (metabolomics/lipidomics)、免疫蛋白質體學(immunoproteomics)等,也一併納入資料庫進行分析。
- 人體腸道總體基因體學研究計畫(Metagenomics of the Human Intestinal Tract Project, MetaHIT)( http://www.metahit.eu/):
2008至2012年間由歐盟資助,由歐洲與中國科學家們完成的腸道總基因體(metagenomics)計畫,共有124位受試者,包括了正常、肥胖以及腸炎患者。並於其糞便檢體中發現一共有1,150種不同菌種,且每位受試者腸道至少存有160樣不同菌種。在鑑定出腸道微生物相後,便能夠針對疾病進行關聯性分析。
- MyNewGut Project(http://www.mynewgut.eu/):
歐盟於2013年12月啟動一項5年期計畫,分析腸道微生物對人體能量平衡、大腦發育與功能之影響,藉此探討微生物相在人類飲食、代謝、行為、免疫中所扮演的角色。
- 美國人腸道菌計畫(American Gut Project)(http://americangut.org/):
2012年,由學者Rob Knight和Jeff Leach發起的一項腸道微生物體計畫。此計畫透過公民科學(citizen science)的方式,鼓勵民眾資助並且提供糞便檢體作為腸道菌的分析,同時民眾也能夠收到關於自己的相關研究報告。由於此計畫不設限於健康族群,並且收樣規模更大,能夠填補人類微生物體計畫的不足。此項計畫已不限於「美國人」,甚至拓展全球,包括英國、澳洲與新加坡都已設立了檢體集合站,送回美國實驗室分析。此計畫可望能成為一個全面性的人類腸道微生物體學資料庫,對於未來微生物與人類的關係性有巨大的影響力。
- 台灣腸道公民科學計畫(Taiwan Gut Project)(https://taiwangut.com/):
就在去年(2017年),一個大型的台灣腸道微生物相計畫也順利起跑了。由長庚大學微生物相研究中心以及圖爾斯生物科技股份有限公司,以產學聯盟方式推動了此項公民科學計畫。有別於上述的微生物體計畫,台灣腸道公民科學計畫更具區域性,可以更精準地分析台灣民眾疾病與腸道微生物的關係,同時也讓國人能夠有機會瞭解自己的腸道菌相,在未來有可能進行特定疾病的預測。本計畫目標設定收集1,000人次,目前已累積約達五百人次。
- 其他微生物體計畫:
除了上述人體微生物體計畫外,尚有2007加拿大人微生物體計畫(Canadian Microbiome Initiative),以及許多針對環境微生物體的大型研究計畫,包括2011年Rob Knight推動的地球微生物體計畫Earth Microbiome Project、美國能源部阿貢國家實驗室(Argonne National Laboratory)於2012年推出的居家微生物體計畫(Home Microbiome Project)和2016年美國白宮推動的國家微生物體啟動計畫(National Microbiome Initiative)。
伴隨著大型微生物體計畫的初步成果完成,科學家們開始進行其與人類疾病關聯上的研究。例如,Yuhao Wang等人證明了腸道微生物能夠刺激腸道上皮細胞STAT3訊息路徑,影響NFIL3基因而控制生理時鐘(Science 2017:357, 912–916)。Hailong Cao等人將有便祕困擾的民眾的腸道菌,以糞菌移植方式轉移到小鼠腸道,驗證此菌相促進大腸上皮細胞的SERT受器表達,使得5-HT神經傳導物質分解,降低了腸道的蠕動(Scientific reports 2017:7;10322)。隨著越來越多的機制被解開,微生物相便能夠與「精準化醫療(precision medicine)」的接軌。從微生物角度,我們可精準地投予或是消滅某特定菌種,而不只是對患者進行糞菌移植。從患者角度,我們也可以精準地瞭解患者微生物相對於疾病和治療的反應。近期《Nature》雜誌中,Wenhan Zhu等人試將鎢以口服給予小鼠,進而抑制了Enterobacteriaceae菌體中的鉬依賴型酵素,藉此減少Enterobacteriaceae並調整腸道菌相組成,使小鼠對於腸炎有較高的抵抗力《Nature》(2018:553;208–211)。而近期的《Science》期刊更是以腸道微生物作為封面,並匯集了3篇關於腸道微生物相干預免疫治療的研究。原來,我們的腸道菌相和免疫抗癌藥物的效果相關,如果能夠瞭解患者的腸道菌相,或進一步地修正成合適的腸道菌相,將可增強抗癌效果(Science 2018:359;32–34)。不久的未來,某種微生物(或某些微生物組合)有可能被作為一種藥物,或是成為藥物作用的對象。
未來挑戰與研究方向
針對微生物相在生物醫學方面研究的未來發展簡列如下:
- 序列定序的進步,使得同一種菌種的不同亞型也得以區分,因此在精準化醫療的未來,微生物相與人類疾病之間的關係可以越來越精準。然而,資料處理量也越來越龐大,利用人工智慧進行運算,將是未來發展的趨勢。
- 有可能鑑定出新的伺機性感染菌種,或是某無害菌種在特定情況下轉為有害。
- 驗證微生物相與人類疾病間的因果關係,以及瞭解其中影響的機制,以作為精準化醫療的依據。
- 許多研究是透過實驗動物進行驗證,然而實驗動物與人類之間仍存在著差異。在實驗動物上的發現,需要在人體上做最終的驗證。
回顧微生物相的文獻,一開始皆為描述性研究,在體學概念導入之後演變成關聯性研究,然後開始進入因果性論證(例如經由糞菌移植試驗),而現在正要跨入的進程是分子機制的探索與驗證。儘管我們對於微生物相的研究已經有了突破性的發展,仍有許多未知須要被發掘與驗證。在地球的發展史上,人類的出現遠不及微生物來的久遠,面對茫茫數不盡的微生物們,人類更顯得渺小。我們才正要掀開微小生物們的神秘面紗,而這不過只是一個大時代的起頭而已。
《文/圖:免疫醫學研究中心張程翔博士後研究員、高承源副研究員》