NHRI Communications

健康知識
奈米抗體新發展
Development in nanobody
 簡介
簡介奈米抗體(nanobody)一詞是來自於駱駝科動物(包含駱駝與羊駝等)的抗體(camelid antibodies),將其單鏈重鏈中的二段重鏈恆定區域(constant region, CH)移除後,最後僅剩的可變區域(variable region, VH)為目前已知最小且具抗原辨識能力的 VHH 單元。傳統的人類或鼠類抗體分子是由重鏈與輕鏈組合,形成一個分子量大約為一百五十 kDa 之Y型二聚體。然而,駱駝科動物抗體不具輕鏈且缺乏位於重鏈上連接可變區與恆定區之第一重鏈恆定區(CH1),使得駝類抗體的單體分子量僅約四十 kDa。在應用上,傳統抗體除了全抗體分子,還會利用抗體工程技術只保留 Fab(分子量為50 kDa)或 scFv(分子量為25 kDa),縮小分子量以利更多的應用;而駝類抗體在加工後更可以縮小到 15 kDa 的VHH,是現今自然界中最迷你的抗原辨識單元,故稱為奈米抗體。「Nanobodies®」也是奈米抗體開發公司 Ablynx 的註冊商標。
科學上意外的發現
科學上的發現有時是在偶然與不經意的情況下促成,奈米抗體的發現也是在這種情形下被分離及鑑定。在比利時布魯賽爾自由大學(Vrije Universiteit Brussel)的 Raymond Hamers博士實驗室一直以來,都在研究駱駝類動物的免疫系統;1989年時,有二位大學部學生向Hamers博士抱怨實驗課很無趣,因為實驗結果都可以預先知道,於是詢問是否可以給他們有趣一點兒的題目。正好Hamers博士的冰箱中有一些用來研究昏睡病的駱駝血,他建議可以用這些駱駝血嘗試純化抗體。學生照做後,發現駱駝抗體雖然也如同傳統抗體般的結構與大小,意外的是,在電泳膠片出現一些令人困惑的較小分子量的抗體分子,看起來像是一種小而簡單的變種抗體。起初,Hamers博士認為這些較小分子量的抗體可能只是放在冰箱太久後的駱駝血所分離出的駱駝抗體降解片段。但是,接著再分析由非洲肯亞送來的新鮮駱駝血,結果也清楚顯示這些較小分子量的變種抗體的存在。最終,這個意外的發現發表於1993年的《Nature》 1。
特殊的結構
Raymond Hamers博士所發現的變種抗體普遍存在於駝科動物(Camelidae family),這些抗體缺乏輕鏈,因此也稱為單域(single domain)或是重鏈(heavy chain)抗體。在結構上,重鏈抗體缺乏連接可變區與恆定區之CH1,僅有 CH2與CH3 區域形成分子量 90 kDa 的二聚抗體。以分子演化的觀點來看,CH1還是存在於駝類基因體中,但在 mRNA 形成後消失,因此駝類抗體只能利用僅有的3個互補性決定區(complementarity-determining regions, CDR) 來維持抗體的高親和力與特異性。
為何奈米抗體值得重視?其中原因可以從奈米抗體的晶體結構得到解釋。首先,奈米抗體的結構大致與傳統抗體的骨架類似,主要由2個 β-sheet 組成主結構,傳統抗體有6個 CDR(3個來自於重鏈,3個來自於輕鏈),而奈米抗體只有3個 CDR,在參與抗原辨識扮演重要角色為第三個 CDR3。與傳統抗體的 CDR3 的 9∼ 12個胺基酸的長度相比,奈米抗體的CDR3 平均長度為 13∼18 個胺基酸,稍長的片段彌補了奈米抗體缺少輕鏈而造成多樣性與親合性不足的缺點。此外,在奈米抗體的構架區域(framework region, FR) 中,相對於傳統抗體中參與輕鏈交互作用的疏水性胺基酸(如V37、 G44、 L45、W47),在奈米抗體中突變成為親水性胺基酸,這個改變使得奈米抗體具有更好的水溶性。在雙硫鍵結形成上,奈米抗體除了已知 FR1-FR3 之間有一對雙硫鍵外,CDR1∼CDR3 之間也會形成雙硫鍵以穩定較長片段的 CDR3 所形成類似凸出環形之三維結構。總結來說,奈米抗體具有較小分子量,高水溶性以及較長的 CDR3 結構,因此可觸及傳統抗體所未能及的抗原區,形成功能更獨特的抗體3。
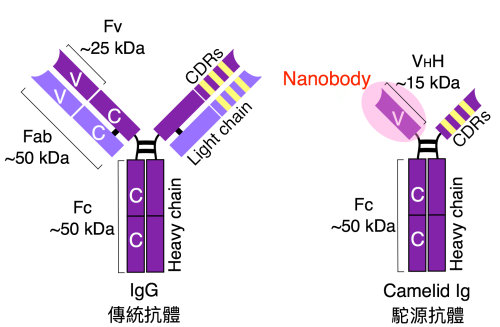
圖說:駱駝科動物(包含駱駝與羊駝等)抗體。傳統抗體包含重鏈(紫色)與輕鏈(淡紫色)之二聚體。駝源抗體僅有重鏈。奈米抗體(nanobody,粉紅色)則是移除重鏈僅保留抗原辨識區域CDR(黃色)
應用上的優點及限制
一般而言,奈米抗體對抗原的親和力與傳統抗體相比不相上下。不過,奈米抗體憑藉其超小分子量,在治療或診斷上更有優於傳統抗體的應用性,例如:
- 快速且更高劑量累積於組織中
- 分子量小使結構更穩定,具有口服或吸入給藥的潛力
- 分子量小,因此進入體內未結合之奈米抗體易被清除,使毒性較低
- 分子量小,應用於分子影像時太容易被清除
- 應用於免疫療法時容易被清除,導致藥效(efficacy)不足
- 由於分子量太小,進行帶藥抗體(antibody-drug conjugate, ADC)應用時,極有可能會改變或減弱奈米抗體原先的特異性或親和力
最新的進展
現今生產這類駝類來源的抗體仍然須要利用免疫駱駝科動物引發免疫反應,再從血液中取得抗體,這些步驟既昂貴又費時。在面對今日抗體藥物的龐大需求,僅靠這些有限的駝類動物來研發抗體藥物無疑是緣木求魚,所幸藉由分子遺傳技術,如噬菌體呈現(phage display)或是酵母菌呈現(yeast display)的方法或可取代傳統的動物免疫實驗。今年(2018)2月發表於《 Nature Structural and Molecular Biology》上的一篇論文提供一個以羊駝抗體為構架之酵母菌表面呈現系統篩選平台2,以此平台為基礎可實現不需以動物免疫實驗研發奈米抗體的作法。哈佛大學醫學院的Andrew Kruse博士調查所有發表在 PDB(Protein Data Bank)上的駝類抗體的結構,他們比較現有的93個序列並統計分析這些抗體晶體CDR上胺基酸的變化與分布。最後的設計原則是在CDR之間的構架區引入少許胺基酸變異度,以維持框架但容許少許自由度;在CDR1與CDR2上的胺基酸變異度是以序列比對結果之胺基酸出現頻率而定,是屬於中等自由度;至於CDR3 則引入最高度的變異度,包括胺基酸出現頻率以及賦予不同的 CDR 長度。其結果大致可以產生 5x108 可供篩選的單株酵母菌庫(library)。緊接著,將預定的標的蛋白質加上螢光標籤配合流式細胞分選儀(fluorescence-activated cell sorter)便可輕易篩選到單株奈米抗體。本論文亦成功展示利用此平台篩選抗 GPCR(G-protein coupled receptor)之奈米抗體,可以應用於穩定 GPCR 之細胞外區域(extracellular domain)之浮動結構,以利於結構生物學之研究。
結語與展望
顧名思義,奈米抗體為現今最迷你具抗原辨識能力的分子。由於分子量極小,奈米抗體具備傳統抗體沒有的優點與應用性,例如高水溶性與穩定度,具穿過血腦障壁(Blood-Brain-Barrier)的潛力或是口服給藥的可能性;然而也由於其分子量太小,較傳統抗體藥有藥物動力學上的劣勢。此外,原本在傳統抗體上可以進行的帶藥抗體的應用也會有所限制。本院生技與藥物研究所近年亦致力於抗體藥物的研發,其中的關鍵技術,如噬菌體或酵母菌呈現平台及帶藥抗體技術也都相當成熟,奈米抗體的應用對於這些新型抗體的藥物研發將會有發揮的空間。
參考資料:
1. Hamers-Casterman C, Atarhouch T, Muyldermans S, Robinson G, Hamers C, Songa EB et al. Naturally occurring antibodies devoid of light chains. Nature 1993; 363: 446-448.
2. McMahon C, Baier AS, Pascolutti R, Wegrecki M, Zheng S, Ong JX et al. Yeast surface display platform for rapid discovery of conformationally selective nanobodies. Nat Struct Mol Biol 2018; 25: 289-296.
3. Nguyen VK, Hamers R, Wyns L, Muyldermans S. Camel heavy-chain antibodies: diverse germline V(H)H and specific mechanisms enlarge the antigen-binding repertoire. EMBO J 2000; 19: 921-930.
《文/圖:生技與藥物研究所王鴻俊助研究員》