NHRI Communications

研究發展
前列腺素受體拮抗劑藉由誘發癌幹細胞胞外體的釋放降低腫瘤對化療的抗藥性
PGE2/EP4 antagonism enhances tumor chemosensitivity by inducing extracellular vesicle-mediated clearance of cancer stem cells
 在臨床治療中,常發現腫瘤對化療藥物會產生抗藥性。經化療無法有效消除的腫瘤常含有間質型的癌幹細胞(mesenchymal-like cancer stem cells),而這些間質性癌幹細胞通常對化療藥物具有高度的抗藥性。即使一般上皮型癌細胞(epithelial-like cancer cells)也可藉由上皮變間質型的轉換(epithelial-mesenchymal transition),而轉變趨近於癌幹細胞的狀態,進而因此提高其對化療藥物的抗藥性。相較於不具有腫瘤生成能力(tumor initiation ability)的一般癌細胞,癌幹細胞通常只占整體腫瘤細胞的一小部分,但此微量癌幹細胞卻足以在腫瘤治療中扮演極為重要的角色。以乳癌為例,一些相對較難治療的種類,例如:類基底細胞型乳癌(basal-like breast cancer)及三陰性乳癌(triple negative breast cancer),都表現較高含量的間質型癌細胞;這類的乳癌即使在治療初期對化療具有良好的反應,其癒後復發的機率通常極高。在經過初期化療之後,這類的腫瘤會在短時間內復發,且復發的腫瘤對化療會產生抗藥性,在沒有其他有效的治療之下,此類復發的腫瘤常造成患者的死亡。腫瘤中微量的間質型癌幹細胞主導了腫瘤的復發、轉移及抗藥性;因此,類基底細胞型乳癌及三陰性乳癌的治療是相對棘手的。
在臨床治療中,常發現腫瘤對化療藥物會產生抗藥性。經化療無法有效消除的腫瘤常含有間質型的癌幹細胞(mesenchymal-like cancer stem cells),而這些間質性癌幹細胞通常對化療藥物具有高度的抗藥性。即使一般上皮型癌細胞(epithelial-like cancer cells)也可藉由上皮變間質型的轉換(epithelial-mesenchymal transition),而轉變趨近於癌幹細胞的狀態,進而因此提高其對化療藥物的抗藥性。相較於不具有腫瘤生成能力(tumor initiation ability)的一般癌細胞,癌幹細胞通常只占整體腫瘤細胞的一小部分,但此微量癌幹細胞卻足以在腫瘤治療中扮演極為重要的角色。以乳癌為例,一些相對較難治療的種類,例如:類基底細胞型乳癌(basal-like breast cancer)及三陰性乳癌(triple negative breast cancer),都表現較高含量的間質型癌細胞;這類的乳癌即使在治療初期對化療具有良好的反應,其癒後復發的機率通常極高。在經過初期化療之後,這類的腫瘤會在短時間內復發,且復發的腫瘤對化療會產生抗藥性,在沒有其他有效的治療之下,此類復發的腫瘤常造成患者的死亡。腫瘤中微量的間質型癌幹細胞主導了腫瘤的復發、轉移及抗藥性;因此,類基底細胞型乳癌及三陰性乳癌的治療是相對棘手的。許多研究指出,前列腺素E2(prostaglandin E2, PGE2)在調節幹細胞恆定中扮演重要的角色。在一些正常組織中,PGE2是維持組織幹細胞(包含造血幹細胞及乳腺幹細胞)所必需的;而在癌症中,PGE2訊息路徑的活化程度和癌症的惡化程度呈正相關。PGE2訊息可藉由多面向影響癌症,包含癌細胞的存活和生長、腫瘤血管的新生及腫瘤的轉移。然而,我們對於PGE2訊息是否調節癌幹細胞恆定及PGE2訊息如何調控癌幹細胞恆定並未徹底瞭解。本院細胞及系統醫學研究所李華容助研究員、林孟杰博士後研究員與陳詩尹研究助理等發現,類基底細胞型乳癌腫瘤表現較高量的環氧合酶(COX-2;產生PGE2所需之酵素)及前列腺素受體(EP4 receptor)(圖1)。腫瘤具有較高COX-2表現量的患者在化療後有較高的癌症復發及死亡率(圖1)。研究團隊進一步分析三陰性乳癌腫瘤發現,有大量的COX-2表現在腫瘤中的間質型癌細胞(圖1),這樣的發現意指,類基底細胞型乳癌及三陰性乳癌的化療後高復發率,可能跟間質型癌細胞中高量的COX-2有關。
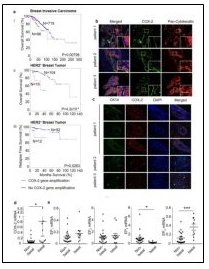
圖1:腫瘤抗化療藥性和其PGE2訊息活化相關。(a)腫瘤具有較高COX-2表現量的患者在化療後有較高的癌症復發及死亡率;(b和c) COX-2表現在腫瘤中的間質型癌細胞;(d和e)類基底細胞型乳癌腫瘤表現較高量的COX-2及EP4 receptor。
(請點擊圖檔放大)
為了釐清PGE2訊息、間質型癌幹細胞和腫瘤抗藥性之間的關係,研究團隊分離間質型癌細胞及上皮型癌細胞,並分別分析其中和PGE2訊息相關之蛋白表現量。分析指出,相較於上皮型細胞,間質型細胞表現較高量的COX-2、前列腺素受體(EP4 receptor)、MRP4(PGE2 transporter)及PGE2(圖2)。較高量的PGE2及PGE2訊息相關之蛋白表現顯示,PGE2訊息可能在維持間質型癌幹細胞中扮演重要角色。利用前列腺素受體拮抗劑(EP4 receptor拮抗劑)阻斷間質型癌幹細胞中的PGE2訊息,可大幅降低間質型癌幹細胞之癌幹細胞特性(圖2)、腫瘤形成/轉移能力(圖2)及抗藥性(圖3)。在此研究中,研究團隊更進一步發現PGE2訊息是如何維持間質型癌幹細胞之癌幹細胞特性、腫瘤形成/轉移能力及抗藥性。此團隊過去研究曾指出PGE2/EP4訊息可調控組織幹細胞胞外體(extracellular vesicles/exosomes)內含物之組成(Stem Cells 2017 Feb;35(2):425-444. doi: 10.1002/stem.2476)。而在癌細胞中,利用EP4 receptor拮抗劑阻斷PGE2訊息可促使間質型癌幹細胞轉變成上皮型癌細胞。研究發現,這樣的轉變是由於阻斷間質型癌幹細胞中的PGE2/EP4訊息,促使間質型癌幹細胞藉由胞外體釋放維持間質型癌幹細胞所需之蛋白,包含癌幹細胞標記、間質標記、整合素(integrins)及drug efflux transporters(圖2、3);因此,釋放胞外體之後,這些癌細胞無法再維持其癌幹細胞特性。相反地,上皮型癌細胞可藉由吞噬間質型癌幹細胞釋放之胞外體,轉變成具有腫瘤形成能力的間質型癌幹細胞。研究更顯示藉由EP4 receptor拮抗劑促使間質型癌幹細胞轉變及降低細胞表面drug efflux transporters的能力,在小鼠乳癌腫瘤模式中給予其EP4 receptor拮抗劑,可除去動物體內腫瘤95%的癌幹細胞,並同時降低殘存癌細胞對化療藥物之抗藥性(圖3)。結合EP4 receptor拮抗劑和傳統化療能更有效地抑制動物體內腫瘤的生長(圖3)。此研究結果意味著在臨床上,結合EP4 receptor拮抗劑和傳統化療的療法將可更有效地治療棘手的類基底細胞型乳癌及三陰性乳癌。

圖2:(a和b)間質型細胞表現較高量的PGE2及PGE2訊息相關之蛋白;(c-i) EP4 receptor拮抗劑阻斷間質型癌幹細胞中的PGE2訊息可促使間質型癌幹細胞釋放胞外體(f、g、h)並大幅降低間質型癌幹細胞之癌幹細胞特性(c、d、e)、腫瘤形成(i)/轉移能力(j、k、l、m)
(請點擊圖檔放大)
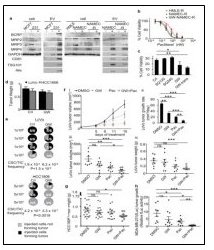
圖3:(a)阻斷PGE2/EP4訊息促使間質型癌幹細胞藉由胞外體釋放drug efflux transporters;(b和c)阻斷PGE2訊息降低間質型癌幹細胞之抗藥性;(d和e)給予EP4 receptor拮抗劑清除腫瘤內95%癌幹細胞;(f和g)結合EP4 receptor拮抗劑和傳統化療可更有效地抑制腫瘤的生長。
(請點擊圖檔放大)
即使已有研究顯示COX-2抑制劑及非類固醇抗發炎藥物(non-steroidal anti-inflammatory drugs, NSAIDs)可降低腫瘤的發生率、發展及轉移,但是,COX-2抑制劑和NSAIDs目前並未被廣泛運用於癌症治療,部分原因是由於此類藥物會提高心血管疾病的風險。有研究指出,COX-2抑制劑和NSAIDs提高心血管疾病風險的機制和其抑制prostacyclin合成相關。而不同於COX-2抑制劑和NSAIDs對於多種prostanoids(包含thromboxane、PGE2及prostacyclin)合成的廣泛抑制,EP4 receptor拮抗劑只會專一地阻斷PGE2藉由EP4 receptor所傳遞的訊息,並不會影響prostanoids(包含prostacyclin)的合成。因此,相較於COX-2抑制劑和NSAIDs,EP4 receptor拮抗劑引起心血管疾病風險的機率可能大幅降低。又藉由此研究發現,EP4 receptor拮抗劑可誘發胞外體的釋放移除癌幹細胞所需之蛋白及drug transporters,進而降低腫瘤中癌幹細胞數量及殘存細胞的抗化療藥性。有鑒於此,研究團隊認為於臨床腫瘤化學治療上佐以EP4 receptor拮抗劑,將可降低腫瘤的抗藥性、提升化療的效能,並可同時避免一般NSAIDs所致之副作用。相關研究成果已發表在《International Journal of Cancer》期刊(2018 Apr 15. doi: 10.1002/ijc.31523.)。
《文/圖:細胞及系統醫學研究所李華容助研究員》