NHRI Communications

知識產權
Pembrolizumab(Keytruda)免疫檢查點抑制劑逆襲事件簿
一場研發戰略與商業考量的拉鋸戰
Some serendipity and battles behind Pembrolizumab
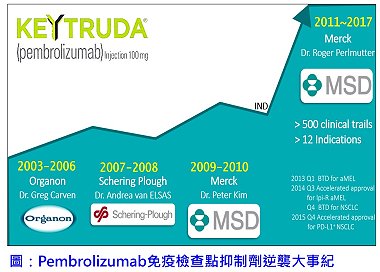 癌症免疫療法(immuno-oncology therapy,簡稱 IO),近來獲得許多突破性的進展,成果令醫學界群起振奮;其中,Pembrolizumab(簡稱Pembro;原名為MK-3475或lambrolizumab;商品名為Keytruda)為一種人源化的單株抗體,具有開啟T細胞被「關閉」的程序性死亡第一型蛋白(programmed cell death protein 1;簡稱PD-1)的效果。最為知名的案例之一是高齡90歲美國前總統卡特(Jimmy Carter),先前被診斷罹患黑色素瘤並已擴散至腦部,經由Keytruda治療後癌細胞業已完全消失;因而公認Keytruda為近期最具潛力的癌症免疫治療藥物。默沙東藥廠(Merck & Co., Inc.;簡稱Merck,在美國及加拿大以外的地區則以Merck Sharp & Dohme為名;簡稱MSD)迄今已啟動超過五百項臨床試驗以評估Keytruda抗癌療效(其中包括三百多項組合試驗),該藥物已獲美國FDA核准用於十多種適應症,後續成果更值得拭目以待。Keytruda堪稱IO藥物之典範,其發展歷程足以拍成一部精采的電影,當中引人入勝的研發過程與競爭對手的機智對決,都極具啟發性及話題性。本文摘錄部分情節供讀者一窺這場免疫療法戰役演進,亦可讓創投業及生技製藥研究開發人員作為借鏡。
癌症免疫療法(immuno-oncology therapy,簡稱 IO),近來獲得許多突破性的進展,成果令醫學界群起振奮;其中,Pembrolizumab(簡稱Pembro;原名為MK-3475或lambrolizumab;商品名為Keytruda)為一種人源化的單株抗體,具有開啟T細胞被「關閉」的程序性死亡第一型蛋白(programmed cell death protein 1;簡稱PD-1)的效果。最為知名的案例之一是高齡90歲美國前總統卡特(Jimmy Carter),先前被診斷罹患黑色素瘤並已擴散至腦部,經由Keytruda治療後癌細胞業已完全消失;因而公認Keytruda為近期最具潛力的癌症免疫治療藥物。默沙東藥廠(Merck & Co., Inc.;簡稱Merck,在美國及加拿大以外的地區則以Merck Sharp & Dohme為名;簡稱MSD)迄今已啟動超過五百項臨床試驗以評估Keytruda抗癌療效(其中包括三百多項組合試驗),該藥物已獲美國FDA核准用於十多種適應症,後續成果更值得拭目以待。Keytruda堪稱IO藥物之典範,其發展歷程足以拍成一部精采的電影,當中引人入勝的研發過程與競爭對手的機智對決,都極具啟發性及話題性。本文摘錄部分情節供讀者一窺這場免疫療法戰役演進,亦可讓創投業及生技製藥研究開發人員作為借鏡。柳暗花明又一村
科學發現往往來自於意外,如眾所周知的盤尼西林抗生素,藥物開發過程也經常是蜿蜒起伏,現代醫藥科學的重大突破常常就誕生於一連串的偶然,背後的故事也相當精彩。舉例來說,有一個傳奇藥品「沙利竇邁(thalidomide)」曾經惡名昭彰,起因於其造成1960年代一起「海豹肢畸形(phocomelia)」的重大藥害事件;然而在藥理方面的突破卻扭轉了沙利竇邁的命運。Takumi Ito博士及其同僚於2010年報導沙利竇邁會與蛋白質cereblon(簡稱CRBN)結合,並能抑制CRBN的酵素活性。更進一步的研究發現「來那度胺(lenalidomide)」是透過跟CRBN的結合能力而誘導在多發性骨髓瘤中非常重要的轉錄因子Ikaros和Aiolos的泛素化和降解(ubiquitination and degradation)。這些藥物機理的研究進而促進了一個新興的藥物化學領域:蛋白裂解靶向嵌合體(PROteolysis TArgeting Chimeras;簡稱PROTAC)技術,從而促進了蛋白降解藥物的開發。這例子也告訴世人,如何透過對於基礎科學的精進以促進突破性發展來造福人群,將會是我們研究者永遠持續的挑戰。
免疫腫瘤學的發展亦存在著極大變化性,憑藉著研究學者靈活變通及堅持,造就這一場耐人尋味的逆襲事件。話說,最早於1992年日本京都大學Tasuku Honjo(本庶 佑)教授首先發現PD-1蛋白,當時對於PD-1所扮演的角色完全不清楚,直至近十年之後,由2002年當時任職於美國梅奧診所(Mayo Clinics)的陳列平教授(現為耶魯大學醫學院教授)研究證實PD-1為T細胞上的一種抑制性受體。接著,2003年荷蘭歐加農(Organon)製藥公司,為擴充業務範圍而選擇開發抗體藥物,依據公司導向設定以PD-1為標的著手開發PD-1激活劑,期望藉由開發激活受體的抗體藥物關閉T細胞,進而抑制自體免疫性疾病患者過度旺盛的免疫反應。然而,團隊開發過程一路跌跌撞撞,即便努力開發,手上的抗體仍僅找到拮抗劑,推測可能用途包括抗病毒劑、癌症應用和疫苗增強劑。當時,拮抗劑對免疫腫瘤學作用機制仍不清楚,經由團隊與公司高層溝通後,最終決定更改方向為PD-1拮抗劑,以銷售考量設定該抗體以治療癌症應用為主軸。該團隊於2006年完成Pembro人源化修飾,並著手準備新藥臨床試驗許可(Investigational New Drug;簡稱 IND)。
2007年在申請新藥試驗的關鍵時刻,公司高層卻拋出震撼彈,美國先靈葆雅(Schering Plough)將收購該公司。先靈葆雅是在為補足公司第II期臨床試驗藥品品項缺口的考量下方才進行併購,故於收購後旋即合併資產,並且對現有計畫進行盤整,並且重新排序後決定暫緩PD-1抗體相關的IND申請,靜待公司重整與檢視評估。當時在重新檢視後,Pembro一度被列為後面的順位;然而領軍的Van Elsas博士仍積極推動該計畫進度,努力為PD-1抗體本身具高度功效,且為具高度專一性之優勢,提供強而有力的科學證據,再次說服高層重新檢視PD-1抗體。接著,該團隊與很有經驗的先靈葆雅腫瘤學小組合作,藉助該小組的科學強項讓Pembro重回該公司的產品線上。然而PD-1抗體開發卻再次遇到挑戰,2009年先靈葆雅被默沙東併購;而這次的併購重組後,卻是決議停止PD-1抗體開發並且準備出售變現。直到2010年必治妥施貴寶(Bristol-Myers Squibb;簡稱BMS)於《新英格蘭醫學雜誌(New England Journal of Medicine)》發表Cytotoxic T-lymphocyte-associated antigen 4(CTLA-4)抑制劑Ipilimumab(商品名:Yervoy)對於轉移性黑色素瘤的第III期臨床試驗研究成果,他們才猛然發現雖然藥物標靶不同,但意謂著「檢查點抑制劑」方法具有潛在功效。及時的報導使默沙東內部緊急重新啟動PD-1抗體開發案,經由剛從安進製藥(Amgen)回巢的首席科學家 Roger Perlmutter博士審慎評估後,決定重新啟動臨床試驗計畫。此次,藉由同樣握有PD-1抑制劑的BMS大力宣傳之下,讓Pembro再次獲得了起死回生的絕佳機會。
掌握先機彎道超車
然而,以眾所矚目的研發與專利時程而言,Pembro並非第一個PD-1抑制劑。早在2006年其競爭對手Medrex開發的nivolumab(商品名:Opdivo)已得到臨床試驗許可,而在Pembro經歷一連串的合併與重組之際,2009年BMS就以24億美金收購Medrex並推動相關臨床試驗,此時Opdivo已遙遙領先技術差距達五年之久。隨後而起的默沙東如何能站穩免疫療法首席地位?又是如何勝出?
2012年,默沙東非臨床安全負責人Joseph DeGeorge博士,在參與一場藥物安全會議時,透過之前美國FDA共事的人脈,聽聞美國FDA政策打算開放加速合理化新藥的核准(accelerated approval)流程,並以突破性指定(breakthrough designation;簡稱BTD)的途徑以解決待滿足的疾病需求,這形同給了Pembro一道通關密語。爾後,美國FDA便與默沙東建立起緊密的合作夥伴關係,透過確定藥物開發最有效的核准途徑,因而加速了Pembro藥物開發。另一方面,當時主導第I期臨床試驗的Antoni Ribas醫師於初期臨床試驗發現,他所治療的7位晚期具抗藥性黑色素瘤患者中,竟有6位患者獲得明顯緩解,憑藉其在晚期黑色素瘤方面的初步成果,在內部說服默沙東大舉押寶,由原本設計為20位患者的臨床試驗直接指數擴充為655人,創下史上最大規模之臨床I期試驗的紀錄。緊接著在2013年1月默沙東申請並獲得Keytruda的BTD狀態,並且由於初步臨床證據優於現有療法,使得該案成為美國FDA授予的癌症藥物突破性治療首例。此一彎道超車路線在當時可視為默沙東檯面下的一張王牌,且為避免競爭對手利用相同監管機制,默沙東選擇低調完成此成果。突破性指定治療更加速Keytruda臨床開發,使得美國FDA在2014年加速核准了Keytruda用於Yervoy治療後仍無法清除,或轉移性黑色素瘤疾病進展的患者。
隨著黑色素瘤工作的進行,默沙東團隊認為該藥物對非小細胞肺癌(non-small cell lung cancer;簡稱NSCLC)患者可能存在潛在益處,特別是使用Pembro作為第二線療法。他們苦思如何獲得快速核准?患者用藥後如何具較高的反應率?隨著臨床開發項目逐步增長,默沙東為加強肺癌腫瘤學研的實力,找來經驗豐富的Martin Huber博士領導NSCLC Pembro臨床試驗。最終擬定的最佳策略為透過生物標誌物的檢測,以區別帶有分子標誌之人群,以藉此確定最可能對藥物有反應的患者。細胞程式死亡-配體1(Programmed death-ligand 1; PD-L 1)為PD-1的天然配體,默沙東選擇以PD-L1的分子表達作為鑑別,相關證據均說明PD-L1會表達於上皮癌症細胞,包括黑色素瘤和非小細胞肺癌細胞的內部及表面。因研發團隊中的Roger Perlmutter博士曾有生物標誌物的經驗,因此而默沙東在臨床開發中利用生物標誌物的決定並不令外界驚訝。其透過實驗設計篩選出具有高表達PD-L1的腫瘤患者,經過Pembro治療後有助於觀察到更高的藥物療效。然而,商業和科學與醫學的道德之間相互牴觸,最初的決議以生物標誌物進行臨床藥物開發是極具爭議性的,例如:使用藥物之前要求患者進行測試非常耗時及不便,對比在相同條件情況下,醫師更願意為了患者立即給予處方,而不是等待測試生物標誌物結果後再施予藥物治療。由於落後競爭對手多年,默沙東團隊因此使出險招,選擇使用有效的生物標誌物,以確保提供藥物後受試患者之成效。當2016年報告結果出來時證實默沙東將Pembro的使用搭配PD-L1標誌檢測的策略是對的。
偉大的成就絕非湊巧
Pembro開發走到此一階段,由漸漸追平後呈現逐步超越競爭對手的態勢。後續默沙東藥廠更是趁勢大舉加碼,以PD-L1表現的情況來排定適應症研究的先後順序,對於Pembro開發工作提供無上限的研究資源,並且以開放態度聽取臨床研究學者的觀察成果,同時加碼不同劑量試驗與其他療法合併組合的可能性。Pembro開發工作仍在如火如荼地持續進行中,除了運用PD-L1表現的觀察結果來精準診斷及用藥外,尚有許多值得仔細挖掘的研究工作,相信在未來有機會創造出更令世人驚嘆的研究成果,以造福癌症患者。發現PD-1蛋白的Tasuku Honjo教授也因其卓越貢獻,於2014年獲頒第1屆生技醫藥類「唐獎」得獎人,由於他對於科學的堅持與不輕易放棄的態度,為免疫腫瘤學在醫學上的應用開創了無限可能。同時得獎的是發現 CTLA-4的James Allison教授,在這領域同樣貢獻卓越的陳列平教授可惜未能同台獲獎,可說是其中的遺珠之憾。除此之外,參與開發的許許多多無名英雄全心的投入與團隊的研究努力,再次讓我們感受到Pembro的偉大並非湊巧,而是起源於卓越的眼光及永不放棄的奮鬥精神。現今,已有多達五種PD-1或 PD-L1抗體,包括Pembro、Nivolumab、Atezolizumab、Avelumab與Durvalumab,透過種種免疫腫瘤學研究與試驗的發現,預期未來將有更多有助於治癒癌症患者的療法將應運而生。
參考文獻:
- The startling history behind Merck’s new cancer blockbuster. Shaywitz D. Forbes. 2017, July 26 02:15am.
- Pembrolizumab KEYNOTE-001: an adaptive study leading to accelerated approval for two indications and a companion diagnostic. Annals of Oncology. 2017 Jun, 28(6):1388-1398.
- 〈沙利竇邁悲劇半世紀〉,李尚仁著,《科學發展》 2015年7月511期。
- Identification of a primary target of thalidomide teratogenicity. Ito T. et al.,Science. 2010 Mar, 327(5971):1345-1350.
- Waste disposal: An attractive strategy for cancer therapy. Salami J and Crews CM, Science. 2017 Mar, 355(6330):1163-1167.
《文/圖:生技與藥物研究所徐祖安研究員、洪慧貞協同研究員/審校:生技與藥物研究所陳炯東所長》